Anhang II – Beispiele für europäische Patentanmeldungen
|
Eine revidierte Fassung dieser Publikation ist in Kraft getreten. |
VERFAHREN FÜR DIE BESTIMMUNG DER TOLERANZ EINER KREBSZELLE GEGENÜBER EINEM HEMMER VOM EPIDERMALEN WACHSTUMGSFAKTOR-REZEPTOR
Erfindungsbezeichnung (Angabe im Erteilungsantrag genügt)
Gebiet der Technik
Die vorliegende Erfindung betrifft ein Verfahren für die Bestimmung der Toleranz einer Krebszelle gegenüber einem Hemmer vom epidermalen Wachstumsfaktor-Rezeptor (nachfolgend als "EGFR-Hemmer" bezeichnet) bei einem menschlichen Patienten, der an einem Krebs leidet.
Technisches Gebiet, auf das sich die Erfindung bezieht
Bisheriger Stand der Technik
EGFR-Hemmer, beispielsweise Antikörperarzneimittel gegen den epidermalen Wachstumsfaktor-Rezeptor (Anti-EGFR-Antikörperarzneimittel), wie etwa Cetuximab und Panitumumab, sind als therapeutisches Mittel gegen Krebs bekannt. Diese EGFR-Hemmer hemmen in Krebszellen die Funktion eines epidermalen Wachstumsfaktor-Rezeptors (Epidermal Growth Factor Receptor, EGFR), der am Wachstum von Krebszellen beteiligt ist.
R. 42 (1) b)
Angabe des bisherigen Stands der Technik
Zudem ist bekannt, dass in einem Fall, bei dem Krebszellen eines Krebspatienten eine Mutation im KRAS-Gen aufweisen, die Krebszellen gegenüber dem EGFR-Hemmer resistent sind und dadurch Wirkungen des EGFR-Hemmers gemindert werden. Der EGFR-Hemmer hat Nebenwirkungen, wie etwa Hautveränderungen, und daher wird es bevorzugt, den EGFR-Hemmer nur an Krebspatienten zu verabreichen, bei denen eine hohe therapeutische Wirksamkeit durch Verabreichung des EGFR-Hemmers erwartet werden kann. Als ein Verfahren für die Bestimmung, ob eine Behandlung mit dem EGFR-Hemmer für den Patienten wirksam ist oder nicht, ist ein Verfahren für die Prüfung der Gegenwart oder Abwesenheit einer Mutation im KRAS-Gen der Krebszellen des Patienten bekannt.
Beispielsweise offenbart WO2014/148557 ein Verfahren für die Vorhersage der Empfindlichkeit gegenüber EGFR-Hemmern, bei dem in einem Fall, bei dem eine aus einem Mutantentyp-KRAS-Gen oder einem Protein davon abgeleitete Nukleinsäure in einer Blutprobe nachgewiesen wird, bestimmt wird, ob eine hohe Wahrscheinlichkeit besteht, dass ein Tumor dem EGFR-Hemmer gegenüber nicht empfindlich ist.
Beurteilung des Stands der Technik
Gemäß Roock et al., Lancet Oncology, Vol. 12, 2011, S. 594–603, führt die BRAF-Mutation V600E zur Resistenz von Krebspatienten gegenüber EGFR-Antikörpern.
Technische Aufgabe
Die Erfinder der vorliegenden Erfindung haben festgestellt, dass die Behandlung mit dem EGFR-Hemmer in einigen Fällen auch für den Krebspatienten, dessen Krebszellen das Wildtyp-KRAS-Gen aufweisen, nicht wirksam ist.
R. 42
Technische Aufgabe
Die vorliegende Erfindung wurde angesichts der vorstehenden Probleme gemacht, und ein Ziel der vorliegenden Erfindung besteht darin, einen Krebspatienten, für den eine Behandlung mit dem EGFR-Hemmer unwirksam ist, im Voraus zu erkennen.
Lösung der Aufgabe
Die vorliegende Erfindung ist ein Verfahren für die Bestimmung der Toleranz einer Krebszelle gegenüber einem EGFR-Hemmer bei einem menschlichen Patienten, der an einem Krebs leidet, wobei das Verfahren einen Schritt der Bestimmung der Gegenwart oder Abwesenheit einer Mutation eines 326. Aminosäurerests einer Aminosäuresequenz eines B-Raf-Proteins (nachfolgend als "B-Raf" bezeichnet) der Krebszelle durch Verwendung einer Probe, die die Krebszelle enthält, die von dem menschlichen Patienten entnommen wurde, umfasst, wobei die Krebszelle als tolerant gegenüber dem Hemmer vom epidermalen Wachstumsfaktor-Rezeptor bestimmt wird, wenn die Mutation des Aminosäurerests vorliegt.
R. 42 (1) c)
Offenbarung der Erfindung
R. 42 (1) c)
Vorteilhafte Wirkungen der Erfindung
Gemäß diesem Verfahren ist es möglich, die Toleranz der Krebszelle gegenüber dem EGFR-Hemmer zu bestimmen, indem die Gegenwart oder Abwesenheit der Mutation eines spezifischen Aminosäurerests, nämlich des 326. Aminosäurerests, in der Aminosäuresequenz des B-Raf der Krebszelle bestimmt wird, und daher ist es möglich, einen Krebspatienten, für den eine Behandlung mit dem EGFR-Hemmer unwirksam ist, im Voraus zu erkennen.
Der vorstehend beschriebene EGFR-Hemmer kann ein Antikörperarzneimittel gegen den epidermalen Wachstumsfaktor-Rezeptor sein.
Die vorstehend beschriebene Bestimmung der Gegenwart oder Abwesenheit der Mutation des Aminosäurerests kann den Nachweis einer Mutation einer Basensequenz einschließen, die den 326. Aminosäurerest der Aminosäuresequenz des B-Raf kodiert.
Der vorstehend beschriebene Nachweis der Mutation der Basensequenz kann durch Folgendes durchgeführt werden: DNA-Sequenzierung, Polymerasekettenreaktion, allelspezifische Amplifikation, Hybridisierung unter Verwendung von allelspezifischen Sonden, Mismatch-Spaltanalyse, Einzelstrang-Konformations-Polymorphismus, denaturierende Gradienten-Gelelektrophorese oder Temperaturgradientengelelektrophorese.
Die vorstehend beschriebene Probe kann eine Krebsresektions-Gewebeprobe, eine Biopsieprobe, eine Aszites-infiltrierende Krebszelle, eine zirkulierende Krebszelle, Serum oder Plasma sein. Wenn diese Proben als Probe verwendet werden, ist es möglich, einen Krebspatienten, für den die Behandlung mit dem EGFR-Hemmer unwirksam ist, mit höherer Sicherheit zu erkennen.
Der Krebs kann ein Kolorektalkrebs oder ein Rektumkrebs sein. Wenn der Krebs ein Kolorektalkrebs oder ein Rektumkrebs ist, ist es möglich, einen Krebspatienten, für den die Behandlung mit dem EGFR-Hemmer unwirksam ist, mit höherer Sicherheit zu erkennen.
Die vorstehend beschriebene Mutation des Aminosäurerests kann I326V sein. Wenn die Mutation I326V ist, ist es möglich, einen Krebspatienten, für den die Behandlung mit dem EGFR-Hemmer unwirksam ist, mit höherer Sicherheit auszuwählen.
Die vorstehend beschriebene Mutation der Basensequenz kann c.976A>G sein. Wenn die Mutation c.976A>G ist, ist es möglich, einen Krebspatienten, für den die Behandlung mit dem EGFR-Hemmer unwirksam ist, mit höherer Sicherheit zu erkennen.
Die vorstehend beschriebene Krebszelle weist vorzugsweise ein Wildtyp-KRAS-Gen auf. Wenn die Krebszelle das Wildtyp-KRAS-Gen aufweist, ist es möglich, einen Krebspatienten, für den die Behandlung mit dem EGFR-Hemmer unwirksam ist, mit höherer Sicherheit zu erkennen.
Vorteilhafte Wirkungen der Erfindung
Gemäß der vorliegenden Erfindung ist es möglich, einen Krebspatienten, für den die Behandlung mit dem EGFR-Hemmer unwirksam ist, im Voraus zu erkennen.
Vorteilhafte Wirkungen der Erfindung
Kurze Beschreibung der Zeichnungen
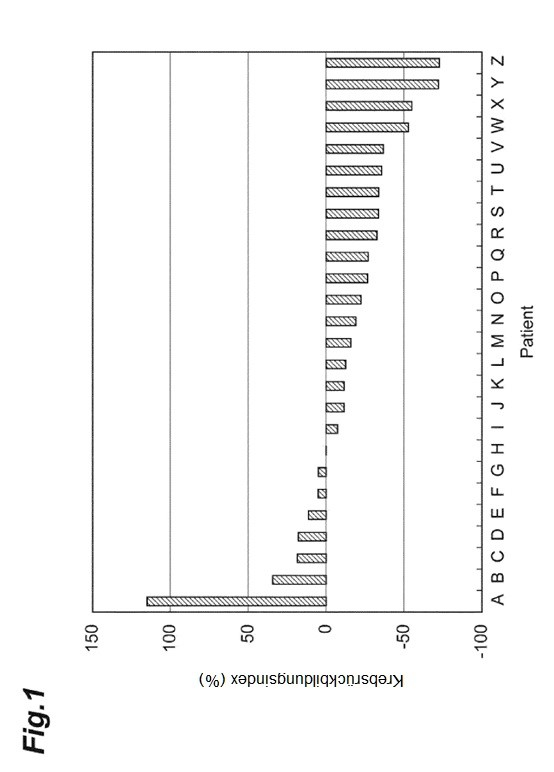
Fig. 1 ist eine grafische Darstellung der Ergebnisse eines Beispiels.
R. 42 (1) d)
Kurze Beschreibung der Zeichnungen
Beschreibung der Ausführungsformen
Im Folgenden werden Ausführungsformen der vorliegenden Erfindung im Einzelnen beschrieben. Die vorliegende Erfindung ist jedoch nicht auf die folgenden Ausführungsformen beschränkt.
R. 42 (1) e)
Beschreibung eines Wegs zur Ausführung der Erfindung unter Bezugnahme auf die Zeichnungen
In einem Aspekt ist die vorliegende Erfindung ein Verfahren für die Bestimmung der Toleranz einer Krebszelle gegenüber einem EGFR-Hemmer bei einem menschlichen Patienten, der an einem Krebs leidet (nachfolgend als "Krebspatient" bezeichnet). Das Verfahren gemäß diesem Aspekt umfasst einen Schritt der Bestimmung der Gegenwart oder Abwesenheit einer Mutation eines 326. Aminosäurerests einer Aminosäuresequenz eines B-Raf der Krebszelle durch Verwendung einer Probe, die die Krebszelle enthält, die von dem menschlichen Patienten entnommen wurde.
Beispiele für Krebsarten, für die das Verfahren gemäß der vorliegenden Erfindung eingesetzt werden kann, sind Kolorektalkrebs, Rektumkrebs, Darmkrebs, Magenkrebs, Leberkrebs, Schilddrüsenkrebs, Gebärmutterkrebs, Nierenkrebs, Bauchspeicheldrüsenkrebs, Zungenkrebs, Prostatakrebs, Lungenkrebs, Hautkrebs, Ovarialkrebs, Gallenblasenkrebs, Kopf- und Halskrebs, Hodenkrebs, Nebennierenkrebs, Mundhöhlenkrebs, Knochen- und Weichteiltumor, Hirntumor, malignes Melanom, Osteosarkom, Chondrosarkom, Rhabdomyosarkom, Leiomyosarkom, Leukämie, malignes Lymphom und multiples Myelom. Bei diesen ist es in einem Fall, bei dem der Krebs ein Kolorektalkrebs oder ein Rektumkrebs ist, möglich, einen Krebspatienten, für den eine Behandlung mit dem EGFR-Hemmer unwirksam ist, mit höherer Sicherheit zu erkennen.
Der "EGFR-Hemmer" in der vorliegenden Beschreibung ist nicht besonders beschränkt, solange der EGFR-Hemmer ein Arzneimittel ist, das die Expression oder Aktivität des EGFR hemmt, und kann eine beliebige niedermolekulare Verbindung sein, die auf den EGFR abzielt, wie etwa Gefitinib und Erlotinib, ein Anti-EGFR-Antikörperarzneimittel, ein EGFR-Antisense-Oligonukleotid, ein Aptamer und dergleichen. Das Anti-EGFR-Antikörperarzneimittel ist beispielsweise ein Antikörper, der die Bindung des epidermalen Wachstumsfaktors (Epidermal Growth Factor, EGF) an den EGFR hemmt. Zu den Beispielen für das Anti-EGFR-Antikörperarzneimittel gehört ein monoklonaler Antikörper, der eine extrazelluläre Domäne des EGFR als Epitop erkennt. Zu spezifischen Beispielen für das Anti-EGFR-Antikörperarzneimittel zählen Cetuximab und Panitumumab. Der EGFR-Hemmer kann allein eingesetzt werden, oder eine Vielzahl von EGFR-Hemmern kann in Kombination eingesetzt werden.
Der "Antikörper" in der vorliegenden Beschreibung umfasst nicht nur ein Antikörper-Molekül mit zwei vollständigen leichten Ketten und zwei vollständigen schweren Ketten, sondern auch ein Antikörperfragment, das zur Bindung an ein Antigen in der Lage ist. Beispiele für das Antikörperfragment sind F(ab’)2, Fab’, Fab und Fv. Der Antikörper ist vorzugsweise entweder ein chimärer Antikörper, ein humanisierter Antikörper oder ein vollständig menschlicher Antikörper.
Darüber hinaus ist das Verfahren gemäß der vorliegenden Ausführungsform auch im Fall der Bestimmung der Toleranz der Krebszelle gegenüber einer Behandlung wirksam, bei der der EGFR-Hemmer und ein anderer Antikrebswirkstoff in Kombination eingesetzt werden. Beispiele für die Behandlung, bei der der EGFR-Hemmer und ein anderer Antikrebswirkstoff in Kombination eingesetzt werden, sind eine Therapie mit CPT-11 plus Panitumumab, eine Therapie mit IRIS plus Panitumumab, eine Therapie mit FOLFOX (z. B. mFOLFOX6) plus Panitumumab, eine Therapie mit FOLFIRI plus Panitumumab, eine Therapie mit CPT-11 plus Cetuximab, eine Therapie mit IRIS plus Cetuximab, eine Therapie mit FOLFOX (z. B. mFOLFOX6) plus Cetuximab, eine Therapie mit FOLFIRI plus Cetuximab und eine Therapie mit sLV5FU2 plus Cetuximab.
Beispiele für die Probe, die die Krebszelle enthält, sind eine Krebsresektions-Gewebeprobe, eine Biopsieprobe, eine Aszites-infiltrierende Krebszelle, eine zirkulierende Krebszelle, Serum, Plasma, Blut, Stuhl, Urin, Sputum, Zerebrospinalflüssigkeit, Pleuraerguss, Nippelaspiratflüssigkeit, Lymphflüssigkeit, Zellkulturflüssigkeit und andere von dem Patienten entnommene Gewebe und Flüssigkeiten. Aus Sicht der Erkennung eines Krebspatienten, für den eine Behandlung mit dem EGFR-Hemmer unwirksam ist, mit höherer Sicherheit ist die Probe, die die Krebszelle enthält, vorzugsweise eine Krebsresektions-Gewebeprobe, eine Biopsieprobe, eine Aszites-infiltrierende Krebszelle, eine zirkulierende Krebszelle, Serum oder Plasma und noch bevorzugter eine Krebsresektions-Gewebeprobe oder eine Biopsieprobe. Darüber hinaus können in einem Fall, bei dem die Probe, die die Krebszelle enthält, die Krebsresektions-Gewebeprobe oder Biopsieprobe ist, diese Proben einer Gefrierbehandlung, Alkoholfixierung, Formalinfixierung, Paraffinumhüllung oder eine Kombination dieser Behandlungen unterzogen werden.
In der vorliegenden Beschreibung bedeutet "Mutation des Aminosäurerests", dass ein spezifischer Aminosäurerest in einer Aminosäuresequenz eines Proteins durch einen Aminosäurerest ausgetauscht wird, der sich von einem Aminosäurerest in einer entsprechenden Wildtyp-Aminosäuresequenz unterscheidet. Beispielsweise ist der in SEQ ID NO: 1 dargestellte 326. Aminosäurerest der Aminosäuresequenz des Wildtyp-B-Raf Isoleucin, und der Austausch dieses Aminosäurerests durch einen anderen Aminosäurerest als Isoleucin wird als die Mutation bezeichnet.
Die Mutation des 326. Aminosäurerests der Aminosäuresequenz des B-Raf kann eine Mutation sein, bei der das Isoleucin durch Phenylalanin, Threonin, Asparaginsäure, Lysin, Serin, Arginin, Methionin, Glycin, Alanin, Valin oder Leucin ausgetauscht wird. In einem Fall, bei dem die Mutation des Aminosäurerests die vorstehend beschriebene Mutation ist, ist es möglich, einen Krebspatienten, für den die Behandlung mit dem EGFR-Hemmer unwirksam ist, mit höherer Sicherheit zu erkennen. Bei diesen ist es in einem Fall, bei dem die Mutation eine Mutation ist (I326V), bei der das Isoleucin durch Valin ausgetauscht wurde, möglich, einen Krebspatienten, für den eine Behandlung mit dem EGFR-Hemmer unwirksam ist, mit höherer Sicherheit zu erkennen.
Die vorstehend beschriebene Bestimmung der Gegenwart oder Abwesenheit der Mutation des Aminosäurerests kann nach bekannten Verfahren durchgeführt werden. Die Bestimmung der Gegenwart oder Abwesenheit der Mutation kann beispielsweise den Nachweis einer Mutation einer Basensequenz einschließen, die den 326. Aminosäurerest der Aminosäuresequenz des B-Raf kodiert.
In der vorliegenden Beschreibung bedeutet "Mutation der Basensequenz", dass mindestens ein Teil der Basen in der Basensequenz durch eine andere Base ausgetauscht wird, sodass der durch die Basensequenz kodierte Aminosäurerest sich dann von einem Aminosäurerest unterscheidet, der durch eine entsprechende Wildtyp-Basensequenz kodiert wurde (auch bezeichnet als "Missense-Mutation").
Die Mutation der Basensequenz, die den 326. Aminosäurerest der Aminosäuresequenz des B-Raf kodiert, kann eine Mutation sein, bei der der durch die Basensequenz kodierte Aminosäurerest von Isoleucin zu Phenylalanin, Threonin, Asparaginsäure, Lysin, Serin, Arginin, Methionin, Glycin, Alanin, Valin oder Leucin verändert wird. In einem Fall, bei dem die Mutation der Basensequenz die vorstehend beschriebene Mutation ist, ist es möglich, einen Krebspatienten, für den die Behandlung mit dem EGFR-Hemmer unwirksam ist, mit höherer Sicherheit zu erkennen. Bei diesen ist es in einem Fall, bei dem die Mutation der Basensequenz eine Mutation ist, bei der die das Isoleucin kodierende Basensequenz zu einer Valin kodierenden mutiert wird (c.976A>G), möglich, einen Krebspatienten, für den die Behandlung mit dem EGFR-Hemmer unwirksam ist, mit höherer Sicherheit zu erkennen.
Der Nachweis der Mutation der Basensequenz kann nach bekannten Verfahren durchgeführt werden. Der Nachweis der Mutation der Basensequenz kann beispielsweise durch Folgendes durchgeführt werden: DNA-Sequenzierung, Polymerasekettenreaktion, allelspezifische Amplifikation, Hybridisierung unter Verwendung von allelspezifischen Sonden, Mismatch-Spaltanalyse, Einzelstrang-Konformations-Polymorphismus, denaturierende Gradienten-Gelelektrophorese oder Temperaturgradientengelelektrophorese. Das Verfahren kann allein verwendet werden, oder eine Vielzahl von Verfahren kann in Kombination verwendet werden.
Wenn die Mutation am 326. Aminosäurerest der Aminosäuresequenz des B-Raf der Krebszelle vorliegt, ist es möglich zu bestimmen, ob die Krebszelle tolerant gegenüber dem EGFR-Hemmer ist.
Der Mechanismus zwischen der Gegenwart oder Abwesenheit der Mutation des 326. Aminosäurerests der Aminosäuresequenz des B-Raf der Krebszelle und der Toleranz der Krebszelle gegenüber dem EGFR-Hemmer ist nicht sicher; die Erfinder der vorliegenden Erfindung spekulieren jedoch, dass die Gegenwart oder Abwesenheit der Mutation und die Toleranz der Krebszelle mindestens im folgenden Mechanismus miteinander verbunden sind. Das B-Raf ist ein Aktivierungsfaktor downstream des EGFR in einem intrazellulären Wachstumssignalweg, der am Krebszellenwachstum beteiligt ist. Der EGFR-Hemmer hat eine Wirkung, bei der die Übertragung von Wachstumssignalen nach downstream des EGFR durch Hemmung der Funktion des EGFR gehemmt wird und somit das Fortschreiten von Krebs unterdrückt wird. Wenn jedoch die Mutation am 326. Aminosäurerest der Aminosäuresequenz des B-Raf der Krebszelle vorliegt, wird das B-Raf auch dann aktiviert, wenn die Wachstumssignale aufgrund des EGFR-Hemmers nicht nach downstream des EGFR übertragen werden und somit die Wachstumssignale nach downstream des B-Raf übertragen werden. Daher wird die Auffassung vertreten, dass die Wirkung der Unterdrückung des Fortschreitens von Krebs auch dann nicht ausgeübt oder vermutlich nicht ausgeübt wird, wenn der EGFR-Hemmer an eine solche Krebszelle verabreicht wird.
Die vorliegende Erfindung kann auch als ein Verfahren für die Bestimmung der Toleranz der Krebszelle gegenüber dem EGFR-Hemmer bei einem menschlichen Patienten, der an einem Krebs leidet, bezeichnet werden, wobei das Verfahren einen Schritt der Bestimmung der Gegenwart oder Abwesenheit einer Mutation eines 326. Aminosäurerests einer Aminosäuresequenz des B-Raf der Krebszelle durch Verwendung der Probe, die die Krebszelle enthält, die von dem menschlichen Patienten entnommen wurde, einschließt, wobei die Gegenwart der Mutation des Aminosäurerests anzeigt, dass die Krebszelle gegenüber dem Anti-EGFR-Antikörperarzneimittel tolerant ist.
Bei einer Ausführungsform kann die von dem Krebspatienten entnommen Krebszelle das Wildtyp-KRAS-Gen aufweisen. Die Behandlung mit dem EGFR-Hemmer ist in einigen Fällen auch dann nicht wirksam, wenn die Krebszellen des Krebspatienten das Wildtyp-KRAS-Gen aufweisen. Gemäß dieser Ausführungsform ist es durch Bewertung der Wirksamkeit des EGFR-Hemmers bei dem Krebspatienten, dessen Krebszellen das Wildtyp-KRAS-Gen aufweisen, möglich, durch den EGFR-Hemmer hervorgerufene unnötige Nebenwirkungen zu vermeiden. In der vorliegenden Beschreibung bedeutet ein Wildtyp-KRAS-Gen ein KRAS-Gen ohne Mutation, das Krebszellen Toleranz gegenüber dem EGFR-Hemmer verleiht. Die Mutation ist eine Genmutation, die eine Veränderung bei der Art von 12. und 13. Aminosäuren des KRAS-Proteins verursacht.
Bei einer Ausführungsform kann der Krebspatient ein Patient sein, der sich einer Behandlung mit der Gabe des EGFR-Hemmers unterziehen will oder unterzogen hat. Gemäß dieser Ausführungsform ist es möglich, bei einem Patienten mit Krebszellen, die gegenüber dem EGFR-Hemmer tolerant sind, die Durchführung der Behandlung mit der Gabe des EGFR-Hemmers zu vermeiden oder die Dosis des EGFR-Hemmers zu verringern. Demgemäß können die durch den EGFR-Hemmer hervorgerufenen Nebenwirkungen vermieden oder verringert werden.
Bei einer Ausführungsform kann die von dem Krebspatienten entnommen Krebszelle ein Wildtyp-NRAS-Gen sowie ein Wildtyp-KRAS-Gen aufweisen. Im Allgemeinen wird eine Behandlung mit dem EGFR-Hemmer als wirksam für die Krebspatienten angesehen, deren Krebszellen ein Wildtyp-NRAS-Gen sowie eine Wildtyp-KRAS-Gen aufweisen. Doch auch unter solchen Patienten gibt es Patienten, für die die Behandlung mit dem EGFR-Hemmer unwirksam ist. Gemäß dieser Ausführungsform ist es möglich, unter solchen Patienten die Patienten zu unterscheiden, für die die Behandlung mit dem EGFR-Hemmer unwirksam ist. In der vorliegenden Beschreibung bedeutet ein Wildtyp-NRAS-Gen ein NRAS-Gen ohne Mutation, das Krebszellen Toleranz gegenüber dem EGFR-Hemmer verleiht. Die Mutation ist beispielsweise eine Genmutation, die eine Veränderung bei der Art einer 12., 13. , 59., 61., 117. oder 146. Aminosäure des NRAS-Proteins verursacht.
In einem Aspekt ist die vorliegende Erfindung ein Verfahren für die Bestimmung der Prognose von Krebs, d. h. ein Verfahren, das die Bestimmung der Gegenwart oder Abwesenheit der Mutation des 326. Aminosäurerests der Aminosäuresequenz des B-Raf der Krebszelle durch Verwendung der von dem menschlichen Patienten, der an dem Krebs leidet, entnommen wurde, einschließt, wobei die Prognose als schlecht bestimmt wird, wenn die Mutation des Aminosäurerests gegenwärtig ist.
Hierin oben wurden die spezifischen Ausführungsformen der vorliegenden Erfindung im Einzelnen beschrieben, doch die vorliegende Erfindung ist nicht auf die vorstehend beschriebenen Ausführungsformen beschränkt.
Beispiele
Nachfolgend wird die vorliegende Erfindung anhand von Beispielen genauer beschrieben, doch die vorliegende Erfindung ist nicht auf die folgenden Beispiele beschränkt.
(Nachweis einer Mutation im BRAF-Gen)
Patienten mit einem Kolorektalkrebs, der keine Mutation in Codons der 12. und 13. Aminosäuren des KRAS-Protein aufwies, wurden mit einer Therapie unter Verwendung von Panitumumab oder Cetuximab behandelt (dargestellt in Tabelle 1). Aus einer Krebsresektionsprobe des Patienten wurde eine formalinfixierte und in Paraffin eingebettete Probe vorbereitet und in dünne Scheiben geschnitten, um zwei Schnitte mit einer Dicke von 20 μm zu präparieren. Eine durch Aufbringung der beiden präparierten Schnitte auf einen Objektträger erhaltene Probe wurde als Probe für eine DNA-Extraktion verwendet. Getrennt davon wurde eine Probe, die durch Präparierung eines Schnitts mit einer Dicke von 4 μm und Aufbringung des präparierten Schnitts auf einen Objektträger erhalten wurde, als Probe für eine mikroskopische Untersuchung verwendet. Proben von 26 Patienten (Patienten A bis Z) wurden präpariert, und für jede Patientenprobe wurden Mutationen in der Basensequenz des BRAF-Gens wie folgt nachgewiesen.
[Tabelle 1]
Patient |
Therapie |
B‑Raf-Mutation |
Krebsrückbildungsindex (in %) |
A |
IRIS + Panitumumab |
1326V |
115 |
B |
IRIS + Panitumumab |
- |
34,3 |
C |
IRIS + Panitumumab |
- |
18,5 |
D |
IRIS + Panitumumab |
- |
17,8 |
E |
IRIS + Panitumumab |
- |
11,3 |
F |
IRIS + Panitumumab |
D22N |
5 |
G |
FOLFIRI + Cetuximab |
- |
5,1 |
H |
IRIS + Panitumumab CPT - 11 + Cetuximab |
- |
0,1 |
I |
IRIS + Panitumumab |
- |
-7,4 |
J |
CPT - 11 + Cetuximab |
- |
-11,6 |
K |
mFOLFOX6 + Panitumumab |
V600E |
-11,5 |
L |
IRIS + Panitumumab |
- |
-12,5 |
M |
mFOLFOX6 + Cetuximab |
- |
-15,9 |
N |
IRIS + Panitumumab |
- |
-19,1 |
O |
IRIS + Panitumumab mFOLFOX6 + Cetuximab sLV5FU2 + Cetuximab |
N581Y |
-22,4 |
P |
IRIS + Panitumumab |
- |
-27 |
Q |
FOLFIRI + Cetuximab |
- |
-26,6 |
R |
CPT - 11 + Cetuximab |
- |
-32,8 |
S |
mFOLFOX6 + Panitumumab |
- |
-33,8 |
T |
IRIS + Panitumumab |
- |
-33,7 |
U |
CPT - 11 + Panitumumab |
V600E |
-35,7 |
V |
CPT - 11 + Panitumumab |
- |
-36,8 |
W |
IRIS + Panitumumab |
- |
-52,8 |
X |
mFOLFOX6 + Cetuximab |
- |
-55 |
Y |
mFOLFOX6 + Panitumumab |
- |
-72,3 |
Z |
IRIS + Panitumumab |
- |
-72,7 |
Die Probe für die mikroskopische Untersuchung wurde mit Hämatoxylin und Eosin angefärbt. Die Probe wurde nach der Anfärbung mit einem Mikroskop untersucht, und in dem Schnitt wurde eine Stelle spezifiziert, die viele Krebszellen enthielt. Von der Probe für die DNA-Extraktion wurde der in der Probe für die mikroskopische Untersuchung spezifizierte Ort mit einer Rasierklinge abgeschabt, und von dem abgeschabten Ort wurde DNA extrahiert. Die DNA-Extraktion wurde durch Verwendung eines BiOstic FFPE Tissue DNA Isolation Kit (Handelsname) durchgeführt.
Das BRAF-Gen wurde aus der DNA der Probe durch Verwendung einer Sondennukleinsäure (als Sonde) isoliert, die einen Teil der oder alle kontinuierlichen Sequenzen (100 bis 130 Basen) in jeder einzelnen von 18 Exonsequenzen des BRAF-Gens enthielt oder eine komplementäre Sequenz davon enthielt. Die Basensequenz des BRAF-Gens wurde mit einem MiSeq-Sequenzierer von Illumina, Inc. analysiert, um Mutationen in der Basensequenz des BRAF-Gens nachzuweisen.
Für den Patienten A wurde in der Basensequenz des BRAF-Gens die Mutation (c.976A>G) nachgewiesen, die die Mutation I326V in der Aminosäuresequenz des B-Raf verursacht. Für die Patienten F, K, O und U wurden in der Aminosäuresequenz des B-Raf in der Basensequenz des BRAF-Gens Mutationen nachgewiesen, die die Mutationen D22N, V600E, N581Y bzw. V600E verursachen. Für die anderen Patienten wurde in der Basensequenz des BRAF-Gens keine Mutation nachgewiesen, die eine Mutation in der Aminosäuresequenz des B-Raf verursacht.
(Wirkung einer Behandlung mit einem Anti-EGFR-Antikörperarzneimittel)
Für die Patienten A bis Z wurde der Krebsrückbildungsindex (in %) nach der folgenden Formel berechnet:
Krebsrückbildungsindex (in %) = (Durchmesser der Primärläsion nach der Behandlung + Durchmesser der metastatischen Läsion nach der Behandlung) / (Durchmesser der Primärläsion vor der Behandlung + Durchmesser der metastatischen Läsion vor der Behandlung) x 100 - 100
Das Verhältnis zwischen der Gegenwart oder Abwesenheit der Mutation des BRAF-Gens und die Wirkung der Behandlung mit dem Anti-EGFR-Antikörperarzneimittel bei den Patienten A bis Z ist in Fig. 1 und den Tabellen 1 und 2 dargestellt.
[Tabelle 2]
B‑Raf-Mutation |
Anzahl der Patienten |
Durchschnittlicher Krebsrückbildungsindex (in %) |
Standardabweichung |
1326V |
1 |
115 |
- |
D22N V600E N581Y |
4 |
-16,3 |
17,3 |
Keine Mutation |
22 |
-19 |
28,9 |
Wie in Fig. 1 und den Tabellen 1 und 2 dargestellt, wurde bei dem Patienten A, für den die Mutation, die die Mutation im 326. Aminosäurerest der Aminosäuresequenz des B-Raf verursacht, in der Basensequenz des BRAF-Gens nachgewiesen wurde, das Fortschreiten von Krebs erkannt, und die Krebszellen des Patienten A wiesen eine Toleranz gegenüber dem Anti-EGFR-Antikörperarzneimittel auf.
SEQUENZPROTOKOLL




Patentansprüche
1. Verfahren für die Bestimmung der Toleranz einer Krebszelle gegenüber einem Hemmer vom epidermalen Wachstumsfaktor-Rezeptor bei einem menschlichen Patienten, der an einem Krebs leidet, wobei das Verfahren Folgendes umfasst:
R. 43 (1) a)
Unabhängiger Anspruch
einen Schritt der Bestimmung der Gegenwart oder Abwesenheit einer Mutation eines 326. Aminosäurerests einer Aminosäuresequenz eines B-Raf-Proteins der Krebszelle durch Verwendung einer Probe, die die Krebszelle enthält, die von dem menschlichen Patienten entnommen wurde,
wobei die Krebszelle als tolerant gegenüber dem Hemmer vom epidermalen Wachstumsfaktor-Rezeptor bestimmt wird, wenn die Mutation des Aminosäurerests vorliegt.
wobei der Hemmer vom epidermalen Wachstumsfaktor-Rezeptor ein Antikörperarzneimittel gegen den epidermalen Wachstumsfaktor-Rezeptor ist
3. Verfahren nach Anspruch 1 oder 2,
wobei die Bestimmung der Gegenwart oder Abwesenheit der Mutation des Aminosäurerests den Nachweis einer Mutation einer Basensequenz einschließt, die den 326. Aminosäurerest der Aminosäuresequenz des B-Raf-Proteins kodiert.
4. Verfahren nach Anspruch 3,
wobei der Nachweis der Mutation der Basensequenz durch Folgendes durchgeführt wird: DNA-Sequenzierung, Polymerasekettenreaktion, allelspezifische Amplifikation, Hybridisierung unter Verwendung von allelspezifischen Sonden, Mismatch-Spaltanalyse, Einzelstrang-Konformations-Polymorphismus, denaturierende Gradienten-Gelelektrophorese oder Temperaturgradientengelelektrophorese.
5. Verfahren nach einem der Ansprüche 1 bis 4,
wobei die Probe eine Krebsresektions-Gewebeprobe, eine Biopsieprobe, eine Aszites-infiltrierende Krebszelle, eine zirkulierende Krebszelle, Serum oder Plasma ist.
6. Verfahren nach einem der Ansprüche 1 bis 5,
wobei der Krebs ein Kolorektalkrebs oder ein Rektumkrebs ist.
7. Verfahren nach einem der Ansprüche 1 bis 6,
wobei die Mutation des Aminosäurerests I326V ist.
8. Verfahren nach Anspruch 3 oder 4,
wobei die Mutation der Basensequenz c.976A>G ist.
9. Verfahren nach einem der Ansprüche 1 bis 8,
wobei die Krebszelle ein Wildtyp-KRAS-Gen aufweist.
Zusammenfassung
VERFAHREN FÜR DIE BESTIMMUNG DER TOLERANZ EINER KREBSZELLE GEGENÜBER EINEM HEMMER VOM EPIDERMALEN WACHSTUMGSFAKTOR-REZEPTOR
Erfindungsbezeichnung
Die vorliegende Erfindung betrifft ein Verfahren für die Bestimmung der Toleranz einer Krebszelle gegenüber einem EGFR-Hemmer bei einem menschlichen Patienten, der an einem Krebs leidet, wobei das Verfahren einen Schritt der Bestimmung der Gegenwart oder Abwesenheit einer Mutation eines 326. Aminosäurerests einer Aminosäuresequenz eines B-Raf-Proteins der Krebszelle durch Verwendung einer Probe, die die Krebszelle enthält, die von dem menschlichen Patienten entnommen wurde, umfasst, wobei die Krebszelle als tolerant gegenüber dem Hemmer vom epidermalen Wachstumsfaktor-Rezeptor bestimmt wird, wenn die Mutation des Aminosäurerests vorliegt, wenn die Mutation des Aminosäurerests vorliegt. Gemäß einem solchen Verfahren ist es möglich, einen Krebspatienten, für den eine Behandlung mit dem EGFR-Hemmer unwirksam ist, im Voraus zu erkennen.