Annexe II – Exemples de demandes de brevet européen
|
Le texte révisé de cette publication est entré en vigueur. |
MÉTHODE DESTINÉE À DÉTERMINER LA TOLÉRANCE D'UNE CELLULE CANCÉREUSE VIS-À‑VIS D'UN INHIBITEUR DU RÉCEPTEUR DU FACTEUR DE CROISSANCE DE L'ÉPIDERME
Titre de l'invention (l'indication dans la requête en délivrance suffit)
Domaine technique
La présente invention concerne une méthode destinée à déterminer la tolérance d'une cellule cancéreuse à un inhibiteur du récepteur du facteur de croissance de l'épiderme chez un patient humain atteint d'un cancer.
R. 42(1)a)
Domaine technique auquel se rapporte l'invention
État de la technique antérieure
Les inhibiteurs du récepteur du facteur de croissance de l'épiderme, par exemple, les anticorps dirigés contre le récepteur du facteur de croissance de l'épiderme (médicament de type anticorps anti-récepteur du facteur de croissance de l'épiderme) comme le cétuximab et le panitumumab, sont connus comme des agents thérapeutiques contre le cancer. Ces inhibiteurs agissent dans les cellules cancéreuses afin d'inhiber la fonction du récepteur du facteur de croissance de l'épiderme qui est impliqué dans la croissance des cellules cancéreuses.
R. 42(1)b)
État de la technique pertinent
Il est également connu que, dans le cas où les cellules cancéreuses d'un patient présentent une mutation du gène KRAS, les cellules cancéreuses résistent à l'inhibiteur du récepteur du facteur de croissance de l'épiderme et, par conséquent, les effets de ce dernier sont réduits. L'inhibiteur du récepteur du facteur de croissance de l'épiderme provoque des effets secondaires tels que des affections cutanées. Il est donc préférable de l'administrer uniquement à des patients atteints d'un cancer pour lesquels un niveau élevé d'efficacité thérapeutique peut être attendu via l'administration de l'inhibiteur du récepteur du facteur de croissance de l'épiderme. Afin de déterminer si un traitement par l'inhibiteur du récepteur du facteur de croissance de l'épiderme est efficace ou non pour le patient, une méthode consistant à vérifier la présence ou l'absence d'une mutation du gène KRAS des cellules cancéreuses est connue.
Par exemple, la publication WO2014/148557 présente un procédé de prédiction de la sensibilité aux inhibiteurs du récepteur du facteur de croissance de l'épiderme, selon lequel, lorsqu'un acide nucléique dérivé du gène KRAS de type mutant ou une protéine de celui-ci est détecté dans un échantillon de sang, alors il existe une forte possibilité qu'une tumeur d'un sujet ne soit pas sensible à un inhibiteur du récepteur du facteur de croissance de l'épiderme.
Appréciation de l'état de la technique
Selon de Roock et al, Lancet Oncology, vol. 12, 2011, p. 594 – 603, la mutation BRAF V600E confère aux patients atteints d'un cancer une résistance aux anticorps anti-récepteur du facteur de croissance de l'épiderme.
Problème technique
Les auteurs de la présente invention ont découvert que le traitement par l'inhibiteur du récepteur du facteur de croissance de l'épiderme n'est pas efficace dans certains cas même pour le patient atteint d'un cancer dont les cellules cancéreuses possèdent un gène KRAS de type sauvage.
Problème technique
La présente invention a été réalisée en vue de résoudre les problèmes soulevés ci-dessus. Elle a notamment pour objet de sélectionner en amont les patients atteints d'un cancer pour lesquels un traitement par l'inhibiteur du récepteur du facteur de croissance de l'épiderme est inefficace.
Solution de ce problème
La présente invention est une méthode destinée à déterminer la tolérance d'une cellule cancéreuse vis-à-vis d'un inhibiteur du récepteur du facteur de croissance de l'épiderme, chez un patient humain atteint d'un cancer. La méthode comprend une étape consistant à établir la présence ou l'absence d'une mutation du 326ème résidu d'acide aminé d'une séquence d'acides aminés d'une protéine B-Raf de la cellule cancéreuse, en utilisant un échantillon contenant la cellule cancéreuse prélevée auprès du patient humain ; où on détermine que la cellule cancéreuse est tolérante vis-à-vis de l'inhibiteur du récepteur du facteur de croissance de l'épiderme, lorsque la mutation du résidu d'acide aminé est présente.
R. 42(1)c)
Exposé de l'invention
R. 42(1)c)
Avantages apportés par l'invention
Selon cette méthode, il est possible de déterminer la tolérance de la cellule cancéreuse vis-à-vis de l'inhibiteur du récepteur du facteur de croissance de l'épiderme en établissant la présence ou l'absence de la mutation d'un résidu d'acide aminé spécifique, à savoir le 326ème résidu d'acide aminé, dans la séquence d'acides aminés de la protéine B-Raf de la cellule cancéreuse. Il est donc possible de sélectionner en amont un patient atteint d'un cancer pour lequel un traitement par l'inhibiteur du facteur de croissance de l'épiderme est inefficace.
L'inhibiteur du récepteur du facteur de croissance de l'épiderme décrit ci-dessus peut être un médicament de type anticorps anti-récepteur du facteur de croissance de l'épiderme.
La détermination de la présence ou de l'absence de la mutation du résidu d'acide aminé décrit ci-dessus peut comporter la détection d'une mutation d'une séquence de base codant pour le 326ème résidu d'acide aminé de la séquence d'acides aminés de la protéine B-Raf.
La détection de la mutation de la séquence de base décrite ci-dessus peut être effectuée par séquençage d'ADN, amplification en chaîne par polymérase, amplification spécifique d'allèles, hybridation à l'aide de sondes spécifiques d'allèles, analyse de clivages des mésappariements, polymorphisme de conformation des simples brins, électrophorèse sur gel en gradient dénaturant, or électrophorèse sur gel à gradient de température.
L'échantillon décrit ci-dessus peut être une pièce d'exérèse de tissu cancéreux, une pièce de biopsie, une cellule cancéreuse infiltrant l'ascite, une cellule cancéreuse circulante, du sérum, ou du plasma. Si ces échantillons sont utilisés, il est possible de sélectionner avec une certitude accrue un patient atteint d'un cancer pour lequel le traitement par l'inhibiteur du récepteur du facteur de croissance de l'épiderme est inefficace.
Le cancer décrit ci-dessus peut être un cancer colorectal ou un cancer rectal. Si le cancer est un cancer colorectal ou un cancer rectal, il est possible de sélectionner avec une certitude accrue un patient atteint d'un cancer pour lequel le traitement par l'inhibiteur du récepteur du facteur de croissance de l'épiderme est inefficace.
La mutation du résidu d'acide aminé décrite ci-dessus peut être la mutation I326V. S'il s'agit de la mutation I326V, il est possible de sélectionner avec une certitude accrue un patient atteint d'un cancer pour lequel le traitement par l'inhibiteur du récepteur du facteur de croissance de l'épiderme est inefficace.
La mutation de la séquence de base décrite ci-dessus peut être la mutation c.976A>G. Si la mutation est c.976A>G, il est possible de sélectionner avec une certitude accrue un patient atteint d'un cancer pour lequel le traitement par l'inhibiteur du récepteur du facteur de croissance de l'épiderme est inefficace.
La cellule cancéreuse décrite ci-dessus possède de préférence un gène KRAS de type sauvage. S'agissant de la cellule cancéreuse possédant le gène KRAS de type sauvage, il est possible de sélectionner avec une certitude accrue un patient atteint d'un cancer pour lequel le traitement par l'inhibiteur du récepteur du facteur de croissance de l'épiderme est inefficace.
Avantages apportés par l'invention
Selon la présente invention, il est possible de sélectionner en amont un patient atteint d'un cancer pour lequel le traitement par l'inhibiteur du récepteur du facteur de croissance de l'épiderme est inefficace.
Avantages apportés par l'invention
Brève description des dessins
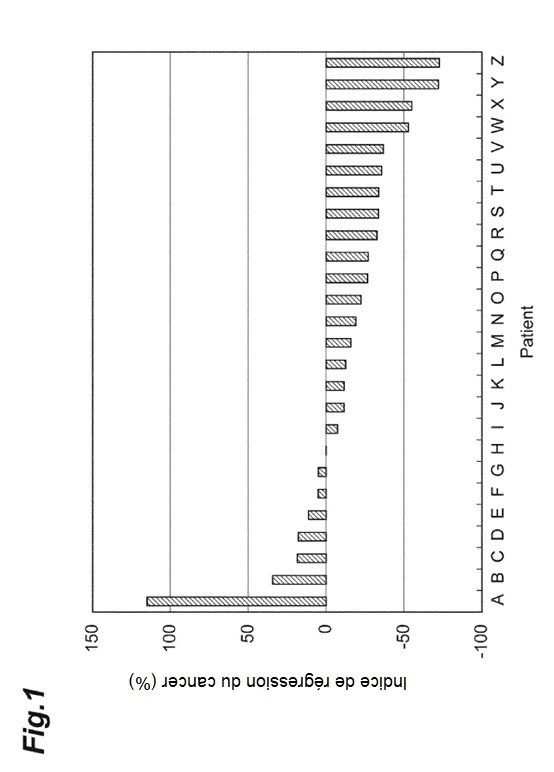
La figure 1 est un graphique présentant les résultats d'un exemple.
R. 42(1)d)
Brève description des dessins
Description des modes de réalisation
Ci-après, les modes de réalisation visant à mettre en œuvre la présente invention seront décrits en détail. Cependant, la présente invention n'est pas limitée aux modes de réalisation suivants.
R. 42(1)e)
Description d'au moins un mode de réalisation de l'invention avec référence aux dessins
Sous un certain aspect, la présente invention est une méthode destinée à établir la tolérance d'une cellule cancéreuse vis-à-vis d'un inhibiteur du récepteur du facteur de croissance de l'épiderme chez un patient humain atteint d'un cancer (ci-après dénommé « patient atteint d'un cancer »). La méthode utilisée sous cet aspect comprend une étape consistant à établir la présence ou l'absence d'une mutation du 326ème résidu d'acide aminé d'une séquence d'acides aminés d'une protéine B-Raf de la cellule cancéreuse, en utilisant un échantillon contenant la cellule cancéreuse prélevée auprès du patient humain.
Les cancers pour lesquels la méthode établie dans le cadre de la présente invention peut être utilisée sont par exemple le cancer colorectal, le cancer rectal, le cancer du côlon, le cancer de l'estomac, le cancer du foie, le cancer de la thyroïde, le cancer de l'utérus, le cancer du rein, le cancer du pancréas, le cancer de la langue, le cancer de la prostate, le cancer du poumon, le cancer de la peau, le cancer de l'ovaire, le cancer de la vésicule biliaire, le cancer de la tête et du cou, le cancer du testicule, le cancer de la glande surrénale, le cancer de la bouche, les tumeurs osseuses et des tissus mous, la tumeur au cerveau, le mélanome malin, l'ostéosarcome, le chondrosarcome, le rhabdomyosarcome, le léiomyosarcome, la leucémie, le lymphome malin, et le myélome multiple. Lorsqu'il s'agit d'un cancer colorectal ou d'un cancer rectal, il est possible de sélectionner en amont un patient atteint d'un cancer pour lequel le traitement par l'inhibiteur du récepteur du facteur de croissance de l'épiderme est inefficace.
L'« inhibiteur du récepteur du facteur de croissance de l'épiderme » dans la présente description n'est pas particulièrement limité tant qu'il s'agit d'un médicament qui inhibe l'expression ou l'activité du récepteur du facteur de croissance de l'épiderme. Il peut s'agir d'un composé de faible poids moléculaire ciblant le récepteur du facteur de croissance de l'épiderme, tel que le géfitinib et l'erlotinib, d'un médicament de type anticorps anti-récepteur du facteur de croissance de l'épiderme, d'un oligonucléotide antisens dirigé contre le récepteur du facteur de croissance de l'épiderme, d'un aptamère, etc. Le médicament de type anticorps anti-récepteur du facteur de croissance de l'épiderme est, par exemple, un anticorps qui inhibe la liaison du facteur de croissance de l'épiderme au récepteur du facteur de croissance de l'épiderme. Un anticorps monoclonal qui reconnaît un domaine extracellulaire du récepteur du facteur de croissance de l'épiderme en tant qu'épitope est un exemple de médicament de type anticorps anti-récepteur du facteur de croissance de l'épiderme. Le cétuximab et le panitumumab sont des exemples spécifiques de médicament de type anticorps anti-récepteur du facteur de croissance de l'épiderme. L'inhibiteur du récepteur du facteur de croissance de l'épiderme peut être utilisé seul, ou en combinaison avec d'autres inhibiteurs du récepteur du facteur de croissance de l'épiderme.
L'« anticorps » dans la présente description englobe non seulement une molécule d'anticorps formée de deux chaînes légères complètes et deux chaînes lourdes complètes, mais également un fragment d'anticorps capable de se lier à un antigène. Des exemples de fragment d'anticorps comprennent F(ab')2, Fab', Fab et Fv. L'anticorps est de préférence soit un anticorps chimérique, soit un anticorps humanisé, soit un anticorps entièrement humain.
De plus, la méthode utilisée dans le cadre du présent mode de réalisation est également efficace lorsqu'il s'agit d'établir la tolérance de la cellule cancéreuse à un traitement dans lequel l'inhibiteur du récepteur du facteur de croissance de l'épiderme est utilisé en association avec un autre agent anticancéreux. Voici plusieurs exemples de traitement dans lesquels l'inhibiteur du récepteur du facteur de croissance de l'épiderme est associé à un autre agent anticancéreux : CPT-11 + panitumumab, IRIS + panitumumab, FOLFOX (par exemple, mFOLFOX6) + panitumumab, FOLFIRI + panitumumab, CPT-11 + cétuximab, IRIS + cétuximab, FOLFOX (par exemple, mFOLFOX6) + cétuximab, FOLFIRI + cétuximab et sLV5FU2 + cétuximab.
Voici plusieurs exemples d'échantillon contenant la cellule cancéreuse : pièce d'exérèse de tissu cancéreux, pièce de biopsie, cellule cancéreuse infiltrant l'ascite, cellule cancéreuse circulante, sérum, plasma, sang, fèces, urine, expectorations, liquide céphalo-rachidien, liquide pleural, écoulement du mamelon, liquide lymphatique, liquide de culture cellulaire et autres tissus et liquides prélevés sur le patient. En vue de sélectionner avec une certitude accrue un patient atteint d'un cancer pour lequel un traitement par l'inhibiteur du récepteur du facteur de croissance de l'épiderme est inefficace, l'échantillon contenant la cellule cancéreuse est de préférence une pièce d'exérèse de tissu cancéreux, une pièce de biopsie, une cellule cancéreuse infiltrant l'ascite, une cellule cancéreuse circulante, du sérum, ou du plasma, en particulier une pièce d'exérèse de tissu cancéreux ou une pièce de biopsie. De plus, dans le cas où l'échantillon contenant la cellule cancéreuse est une pièce d'exérèse de tissu cancéreux ou une pièce de biopsie, ces échantillons peuvent être soumis à la congélation, à la fixation dans l'alcool, à la fixation au formol, à l'inclusion en paraffine ou à une combinaison de ces procédés.
Dans la présente description, la « mutation du résidu d'acide aminé » signifie qu'un résidu d'acide aminé spécifique dans une séquence d'acides aminés d'une protéine est remplacé par un résidu d'acide aminé différent d'un résidu d'acide aminé dans une séquence d'acides aminés correspondante de type sauvage. Prenons l'exemple du 326ème résidu d'acides aminés de la séquence d'acides aminés de la protéine B-Raf de type sauvage montré dans le SEQ ID NO : 1 est l'isoleucine, et la substitution de ce résidu d'acide aminé par un résidu d'acide aminé autre que l'isoleucine est appelée la mutation.
La mutation du 326ème résidu d'acides aminés de la séquence d'acides aminés de la protéine B-Raf peut être une mutation dans laquelle l'isoleucine est remplacée par la phénylalanine, la thréonine, l'acide aspartique, la lysine, la sérine, l'arginine, la méthionine, la glycine, l'alanine, la valine, ou la leucine. Dans le cas où la mutation du résidu d'acide aminé est la mutation décrite ci-dessus, il est possible de sélectionner avec une certitude accrue un patient atteint d'un cancer pour lequel un traitement par l'inhibiteur du récepteur du facteur de croissance de l'épiderme est inefficace. Dans le cas où la mutation est une mutation (I326V) dans laquelle l'isoleucine a été substituée par la valine, il est possible de sélectionner avec une certitude accrue un patient atteint d'un cancer pour lequel un traitement par l'inhibiteur du récepteur du facteur de croissance de l'épiderme est inefficace.
La détermination de la présence ou de l'absence de la mutation du résidu d'acide aminé décrite ci-dessus peut être mise en œuvre par des méthodes connues. La détermination de la présence ou de l'absence de la mutation peut comporter, par exemple, la détection d'une mutation d'une séquence de base codant pour le 326ème résidu d'acide aminé de la séquence d'acides aminés de la protéine B-Raf.
Dans la présente description, « mutation de la séquence de base » signifie qu'une partie au moins des bases de la séquence de base est remplacée par une autre base de sorte que le résidu d'acide aminé codé par la séquence de base devient différent d'un résidu d'acide aminé codé par une séquence de base correspondante (de type sauvage) (également appelé « mutation faux-sens »).
La mutation de la séquence de base qui code pour le 326ème résidu d'acide aminé de la séquence d'acides aminés de la protéine B-Raf peut être une mutation dans laquelle l'isoleucine correspondant au résidu d'acide aminé codé par la séquence de base est remplacée par la phénylalanine, la thréonine, l'acide aspartique, la lysine, la sérine, l'arginine, la méthionine, la glycine, l'alanine, la valine, ou la leucine. Dans un cas où la mutation de la séquence de base est la mutation décrite ci-dessus, il est possible de sélectionner avec une certitude accrue un patient atteint d'un cancer pour lequel le traitement par l'inhibiteur du récepteur du facteur de croissance de l'épiderme est inefficace. Dans un cas où la mutation de la séquence de base est une mutation dans laquelle la séquence de base codant pour l'isoleucine est mutée en séquence de base codant pour la valine (c.976A>G), il est possible de sélectionner avec une certitude accrue un patient atteint d'un cancer chez qui le traitement par l'inhibiteur du récepteur du facteur de croissance de l'épiderme est inefficace.
La détection de la mutation de la séquence de base peut être mise en œuvre par des méthodes connues. La détection de la mutation de la séquence de base peut être mise en oeuvre, par exemple, par séquençage d'ADN, amplification en chaîne par polymérase, amplification spécifique d'allèles, hybridation à l'aide de sondes spécifiques d'allèles, analyse de clivages des mésappariements, polymorphisme de conformation des simples brins, électrophorèse sur gel en gradient dénaturant, ou électrophorèse sur gel à gradient de température. La technique peut être utilisée seule, ou plusieurs techniques peuvent être combinées.
Si la mutation existe sur le 326ème résidu d'acide aminé de la séquence d'acides aminés de la protéine B-Raf de la cellule cancéreuse, il est possible d'établir que la cellule cancéreuse est tolérante vis-à-vis de l'inhibiteur du récepteur du facteur de croissance de l'épiderme.
Le mécanisme existant entre, d'une part, la présence ou l'absence d'une mutation du 326ème résidu d'acide aminé d'une séquence d'acides aminés d'une protéine B-Raf de la cellule cancéreuse et, d'autre part, la tolérance de la cellule cancéreuse vis-à-vis de l'inhibiteur du récepteur du facteur de croissance de l'épiderme n'est pas évident ; toutefois, les inventeurs de la présente invention émettent l'hypothèse que la présence ou l'absence de la mutation, d'une part, et la tolérance de la cellule cancéreuse, d'autre part, sont liées les unes aux autres au moins dans le mécanisme suivant. La protéine B-Raf est un facteur d'activation présent en aval du récepteur du facteur de croissance de l'épiderme dans une voie de signalisation de croissance intracellulaire intervenant dans la croissance des cellules cancéreuses. L'inhibiteur du récepteur du facteur de croissance de l'épiderme a un effet dans lequel les signaux de croissance sont empêchés d'être transmis en aval du récepteur du facteur de croissance de l'épiderme en inhibant la fonction du récepteur du facteur de croissance de l'épiderme, supprimant ainsi la progression du cancer. Cependant, si la mutation existe sur le 326e résidu d'acide aminé de la séquence d'acides aminés de la protéine B-Raf de la cellule cancéreuse, la protéine B-Raf est activée même lorsque les signaux de croissance ne sont pas transmis en aval du récepteur du facteur de croissance de l'épiderme en raison de l'inhibiteur du récepteur du facteur de croissance de l'épiderme. Ainsi, on considère que, même si l'inhibiteur du récepteur du facteur de croissance de l'épiderme est administré à cette cellule cancéreuse, l'effet de la suppression de la progression du cancer ne s'exerce pas, ou est peu susceptible de s'exercer.
La présente invention peut également être une méthode destinée à déterminer la tolérance de la cellule cancéreuse vis-à-vis de l'inhibiteur du récepteur du facteur de croissance de l'épiderme chez un patient humain atteint d'un cancer, la méthode comprenant une étape consistant à établir la présence ou l'absence de la mutation du 326ème résidu d'acide aminé de la séquence d'acides aminés de la protéine B-Raf de la cellule cancéreuse, en utilisant l'échantillon contenant la cellule cancéreuse prélevée auprès du patient humain, où la présence de la mutation du résidu d'acide aminé indique que la cellule cancéreuse est tolérante vis-à-vis du médicament de type anticorps anti-récepteur du facteur de croissance de l'épiderme.
Dans un mode de réalisation, la cellule cancéreuse prélevée auprès du patient atteint d'un cancer peut contenir le gène KRAS de type sauvage. Le traitement par l'inhibiteur du récepteur du facteur de croissance de l'épiderme n'est pas efficace dans certains cas même si les cellules cancéreuses du patient atteint d'un cancer contiennent le gène KRAS de type sauvage. Selon ce mode de réalisation, en évaluant l'efficacité de l'inhibiteur du récepteur du facteur de croissance de l'épiderme chez le patient atteint d'un cancer dont les cellules cancéreuses contiennent le gène KRAS de type sauvage, il est possible d'éviter des effets secondaires inutiles causés par l'inhibiteur du récepteur du facteur de croissance de l'épiderme. Dans la présente description, un gène KRAS de type sauvage désigne un gène KRAS n'ayant pas de mutation offrant aux cellules cancéreuses une tolérance à l'inhibiteur du récepteur du facteur de croissance de l'épiderme. La mutation est une mutation génétique qui provoque une altération dans le type des 12e et 13e acides aminés de la protéine KRAS.
Dans un mode de réalisation, le patient atteint d'un cancer peut être un patient qui a l'intention de subir un traitement ou qui a subi un traitement médicamenteux avec l'inhibiteur du récepteur du facteur de croissance de l'épiderme. Selon ce mode de réalisation, il est possible d'éviter l'administration du traitement médicamenteux avec l'inhibiteur du récepteur du facteur de croissance de l'épiderme à un patient ayant des cellules cancéreuses tolérantes vis-à-vis de l'inhibiteur du récepteur du facteur de croissance de l'épiderme, ou de réduire une dose de l'inhibiteur du récepteur du facteur de croissance de l'épiderme. C'est ainsi que les effets secondaires causés par l'inhibiteur du récepteur du facteur de croissance de l'épiderme peuvent être évités ou atténués.
Dans un mode de réalisation, la cellule cancéreuse prélevée auprès du patient atteint d'un cancer peut contenir un gène NRAS de type sauvage ainsi qu'un gène KRAS de type sauvage. De manière générale, un traitement par l'inhibiteur du récepteur du facteur de croissance de l'épiderme est considéré comme efficace pour les patients atteints d'un cancer dont les cellules cancéreuses contiennent un gène NRAS de type sauvage ainsi qu'un gène KRAS de type sauvage. Toutefois, même parmi ces patients, il en est pour lesquels le traitement par l'inhibiteur du récepteur du facteur de croissance de l'épiderme est inefficace. Selon ce mode de réalisation, il est possible de distinguer les patients pour lesquels le traitement par l'inhibiteur du récepteur du facteur de croissance de l'épiderme est inefficace parmi ces patients atteints d'un cancer. Dans la présente description, un gène NRAS de type sauvage désigne un gène NRAS n'ayant pas de mutation offrant aux cellules cancéreuses une tolérance vis-à-vis de l'inhibiteur du récepteur du facteur de croissance de l'épiderme. La mutation, par exemple, est une mutation génétique qui provoque une altération dans le type des 12ème, 13ème, 59ème, 61ème, 117ème, ou 146ème acides aminés de la protéine KRAS.
Sous un certain aspect, la présente invention est une méthode destinée à établir le pronostic du cancer, à savoir, une méthode qui suppose la détermination de la présence ou de l'absence de la mutation du 326e résidu d'acide aminé de la séquence d'acides aminés de la protéine B-Raf de la cellule cancéreuse, en utilisant l'échantillon contenant la cellule cancéreuse prélevée auprès du patient humain atteint du cancer, le pronostic étant établi comme mauvais, lorsque la mutation du résidu de l'acide aminé est présente.
Ci-dessus, les réalisations spécifiques de la présente invention sont décrites en détail, mais la présente invention ne se limite pas aux réalisations décrites ci-dessus.
Exemples
Ci-après, la présente invention sera décrite plus précisément sur la base d'exemples, mais celle-ci ne se limite pas aux exemples ci-après.
(Détection de la Mutation dans le gène B-Raf)
Les patients atteints d'un cancer colorectal n'ayant aucune mutation dans les codons des 12e et 13e acides aminés de la protéine KRAS ont été traités avec une thérapie utilisant du panitumumab ou du cetuximab (comme l'indique le tableau 1). Un échantillon fixé au formol et inclus en paraffine a été préparé à partir d'une pièce d'exérèse de tissu cancéreux du patient, et sectionné en coupes fines pour la préparation de deux coupes de 20 μm d'épaisseur. Un échantillon obtenu en fixant les deux coupes préparées sur une lame de verre a été utilisé comme échantillon pour l'extraction d'ADN. D'autre part, un échantillon obtenu en préparant une coupe de 4 μm d'épaisseur, et en fixant la coupe préparée sur une lame de verre, a été utilisé pour l'observation microscopique. Les échantillons de 26 patients (patients A à Z) ont été préparés, et des mutations dans la séquence de base du gène B-Raf ont été détectées pour chaque échantillon prélevé auprès de patients de la manière suivante.
[Tableau 1]
Patient |
Thérapie |
Mutation B-Raf |
Indice de régression du cancer (%) |
A |
IRIS + Panitumumab |
1326V |
115 |
B |
IRIS + Panitumumab |
- |
34,3 |
C |
IRIS + Panitumumab |
- |
18,5 |
D |
IRIS + Panitumumab |
- |
17,8 |
E |
IRIS + Panitumumab |
- |
11,3 |
F |
IRIS + Panitumumab |
D22N |
5 |
G |
FOLFIRI + Cetuximab |
- |
5,1 |
H |
IRIS + Panitumumab CPT - 11 + Cetuximab |
- |
0,1 |
I |
IRIS + Panitumumab |
- |
-7,4 |
J |
CPT - 11 + Cetuximab |
- |
-11,6 |
K |
mFOLFOX6 + Panitumumab |
V600E |
-11,5 |
L |
IRIS + Panitumumab |
- |
-12,5 |
M |
mFOLFOX6 + Cetuximab |
- |
-15,9 |
N |
IRIS + Panitumumab |
- |
-19,1 |
O |
IRIS + Panitumumab mFOLFOX6 + Cetuximab sLV5FU2 + Cetuximab |
N581Y |
-22,4 |
P |
IRIS + Panitumumab |
- |
-27 |
Q |
FOLFIRI + Cetuximab |
- |
-26,6 |
R |
CPT - 11 + Cetuximab |
- |
-32,8 |
S |
mFOLFOX6 + Panitumumab |
- |
-33,8 |
T |
IRIS + Panitumumab |
- |
-33,7 |
U |
CPT - 11 + Panitumumab |
V600E |
-35,7 |
V |
CPT - 11 + Panitumumab |
- |
-36,8 |
W |
IRIS + Panitumumab |
- |
-52,8 |
X |
mFOLFOX6 + Cetuximab |
- |
-55 |
Y |
mFOLFOX6 + Panitumumab |
- |
-72,3 |
Z |
IRIS + Panitumumab |
- |
-72,7 |
L'échantillon prévu pour l'observation microscopique a été coloré avec de l'hématoxyline et de l'éosine. L'échantillon après coloration a été observé au microscope et un site contenant de nombreuses cellules cancéreuses dans la coupe a été spécifié. À partir de l'échantillon prévu pour l'extraction d'ADN, le site spécifié dans l'échantillon pour l'observation microscopique a été gratté avec une lame, et l'ADN a été extrait du site gratté. L'extraction de l'ADN a été réalisée en utilisant le kit d'isolement d'ADN BiOstic (nom commercial) des tissus fixés au formol et inclus en paraffine.
On a isolé le gène B-Raf de l'ADN de l'échantillon en utilisant, comme sonde, un acide nucléique sonde contenant une partie ou la totalité des séquences continues (100 à 130 bases) dans chacune des 18 séquences d'exons du gène B-Raf, ou contenant une séquence complémentaire. La séquence de base du gène B-Raf a été analysée par le séquenceur MiSeq d'Illumina, Inc. afin de détecter des mutations dans la séquence de base du gène B-Raf.
Pour le patient A, la mutation (c.976A>G) qui provoque la mutation de I326V dans la séquence d'acides aminés du B-Raf a été détectée dans la séquence de base du gène B-Raf. Pour les patients F, K, O et U, des mutations provoquant des mutations de D22N, V600E, N581Y et V600E, respectivement, ont été détectées dans la séquence d'acides aminés du B-Raf dans la séquence de base du gène B-Raf. Chez les autres patients, aucune mutation provoquant une mutation dans la séquence d'acides aminés du B-Raf n'a été détectée dans la séquence de base du gène B-Raf.
(Effet du traitement avec un médicament de type anticorps anti-récepteur du facteur de croissance de l'épiderme)
Pour les patients A à Z, un indice de régression du cancer (%) a été calculé selon la formule ci-après :
Indice de régression du cancer (%) = (diamètre de la lésion primaire après traitement + diamètre de la lésion métastatique après traitement) / (diamètre de la lésion primaire avant traitement + diamètre de la lésion métastatique avant traitement) x 100 - 100
La relation entre, d'une part, la présence ou l'absence de la mutation du gène B-Raf et, d'autre part, l'effet du traitement utilisant un médicament de type anticorps anti-récepteur du facteur de croissance de l'épiderme chez les patients A à Z est illustrée à la figure 1 et aux tableaux 1 et 2.
[Tableau 2]
Mutation B-Raf |
Nombre de patients |
Indice moyen de régression du cancer (%) |
Écart-type |
1326V |
1 |
115 |
- |
D22N V600E N581Y |
4 |
-16,3 |
17,3 |
Aucune mutation |
22 |
-19 |
28,9 |
Comme le montrent la figure 1 et les tableaux 1 et 2, chez le patient A pour lequel la mutation provoquant la mutation dans le 326e résidu d'acide aminé de la séquence d'acides aminés du B-Raf a été détectée dans la séquence de base du gène B-Raf, la progression du cancer a été constatée, et les cellules cancéreuses du patient A présentaient une tolérance vis-à-vis du médicament de type anticorps anti-récepteur du facteur de croissance de l'épiderme.
LISTAGE DE SEQUENCES




Revendications
1. Méthode destinée à déterminer la tolérance d'une cellule cancéreuse vis-à-vis d'un inhibiteur du récepteur du facteur de croissance de l'épiderme, chez un patient humain atteint d'un cancer, la méthode comprenant :
R. 43(1)a)
Revendication indépendante
une étape consistant à établir la présence ou l'absence d'une mutation du 326ème résidu d'acide aminé d'une séquence d'acides aminés d'une protéine B-Raf de la cellule cancéreuse, en utilisant un échantillon contenant la cellule cancéreuse prélevée auprès du patient humain ;
où on détermine que la cellule cancéreuse est tolérante vis-à-vis de l'inhibiteur du récepteur du facteur de croissance de l'épiderme, lorsque la mutation du résidu d'acide aminé est présente.
3. Méthode selon la revendication 1 ou 2,
dans laquelle la détermination de la présence ou de l'absence de la mutation du résidu d'acide aminé comporte la détection d'une mutation d'une séquence de base codant pour le 326ème résidu d'acide aminé de la séquence d'acides aminés de la protéine B-Raf.
4. Méthode selon la revendication 3, dans laquelle la détection de la mutation de la séquence de base est mise en œuvre par séquençage d'ADN, amplification en chaîne par polymérase, amplification spécifique d'allèles, hybridation à l'aide de sondes spécifiques d'allèles, analyse de clivages des mésappariements, polymorphisme de conformation des simples brins, électrophorèse sur gel en gradient dénaturant, ou électrophorèse sur gel à gradient de température.
5. Méthode selon l'une quelconque des revendications 1 à 4, dans laquelle l'échantillon est une pièce d'exérèse de tissu cancéreux, une pièce de biopsie, une cellule cancéreuse infiltrant l'ascite, une cellule cancéreuse circulante, du sérum, ou du plasma.
6. Méthode selon l'une quelconque des revendications 1 à 5, dans laquelle le cancer est un cancer colorectal ou un cancer rectal.
7. Méthode selon l'une quelconque des revendications 1 à 6, dans laquelle la mutation du résidu d'acide aminé est I326V.
8. Méthode selon la revendication 3 ou 4,
dans laquelle la mutation de la séquence de base est c.976A>G.
9. Méthode selon l'une quelconque des revendications 1 à 8, dans laquelle la cellule cancéreuse possède un gène KRAS de type sauvage.
Abrégé
METHODE DESTINEE A DETERMINER LA TOLERANCE D'UNE CELLULE CANCEREUSE VIS-A‑VIS D'UN INHIBITEUR DU RECEPTEUR DU FACTEUR DE CROISSANCE DE L'EPIDERME
R. 47(1)
Titre de l'invention
La présente invention offre une méthode destinée à déterminer la tolérance d'une cellule cancéreuse vis-à-vis d'un inhibiteur du récepteur du facteur de croissance de l'épiderme chez un patient humain atteint d'un cancer, la méthode comprenant une étape consistant à établir la présence ou l'absence d'une mutation du 326ème résidu d'acide aminé d'une séquence d'acides aminés d'une protéine B-Raf de la cellule cancéreuse, en utilisant un échantillon contenant la cellule cancéreuse prélevée auprès du patient humain, où la cellule cancéreuse est déterminée comme tolérante vis-à-vis de l'inhibiteur, lorsque la mutation du résidu d'acide aminé est présente. Selon cette méthode, il est possible de sélectionner en amont un patient atteint d'un cancer pour qui un traitement par l'inhibiteur du récepteur du facteur de croissance de l'épiderme est inefficace.