Thérapies
L'objectif ultime de la thérapie anticancéreuse est d'éliminer à la fois la tumeur et les cellules cancéreuses circulantes sans nuire aux tissus sains. Malgré les nombreuses thérapies disponibles aujourd'hui, il n'est pas possible d'obtenir une rémission totale pour tous les cancers. La complexité de la maladie rend particulièrement difficile la mise au point de traitements sûrs et efficaces. Les recherches présentées dans cette section illustrent la gamme d'outils à la disposition des oncologues et les approches multimodales qui peuvent être utilisées pour attaquer les cellules cancéreuses, réduire leur propagation et induire une réponse immunitaire systémique anticancéreuse contre la tumeur primitive et les métastases.
- Chirurgie
-
Les ensembles de données suivants concernent les interventions invasives qui visent à éliminer la tumeur solide ou au moins à la réduire. Ils couvrent les documents brevets visant à améliorer la résection de la tumeur sans endommager les tissus environnants ou nuire au patient.
Chirurgie conventionnelle
La chirurgie de haute précision comprend tout type de chirurgie assistée par ordinateur (CAS) avec une planification basée sur l'image et une exécution manuelle ou (semi-)automatique. Elle comprend la mise en correspondance en temps réel des images pré-chirurgicales avec les images en direct afin de guider le chirurgien vers les régions d'intérêt. Des marqueurs peuvent être utilisés pour soutenir la planification ou faciliter l'accès répété.
Chirurgie assistée par ordinateur et robotique
Traitement par le froid
La thérapie par le froid peut être utilisée pendant l'opération pour protéger les tissus sains et réduire le risque d'effets secondaires. La thérapie par le froid peut également être utilisée pour détruire les cellules cancéreuses en gelant la tumeur et les tissus environnants afin d'assurer une marge de sécurité. Le tissu congelé peut ensuite être retiré par voie chirurgicale.
Utilisation d'une sonde à extrémité ouverte
En combinaison avec un appareil à ultrasons
En combinaison avec la chirurgie d'exérèse conventionnelle
Traitement par le chaud
Le chauffage chirurgical du cancer, également connu sous le nom d'ablation thermique, est un traitement qui utilise la chaleur pour détruire les cellules tumorales. Il peut être réalisé au cours d'une intervention chirurgicale ou en tant que procédure peu invasive. L'utilisation de la chaleur peut également réduire les saignements associés à la chirurgie.
Coagulation avec chirurgie d'exérèse conventionnelle
Passage de courant à travers les tissus
Hyperthermie ultrasonore localisée
Traitement de la coagulation avec un seul instrument
Poration cellulaire
Ce traitement contre le cancer peut être réalisé pendant une intervention chirurgicale et utilise des impulsions électriques pour créer des pores dans la membrane cellulaire. Cela permet aux agents thérapeutiques de pénétrer plus facilement dans la cellule et de tuer les cellules cancéreuses.
- Radiothérapie
-
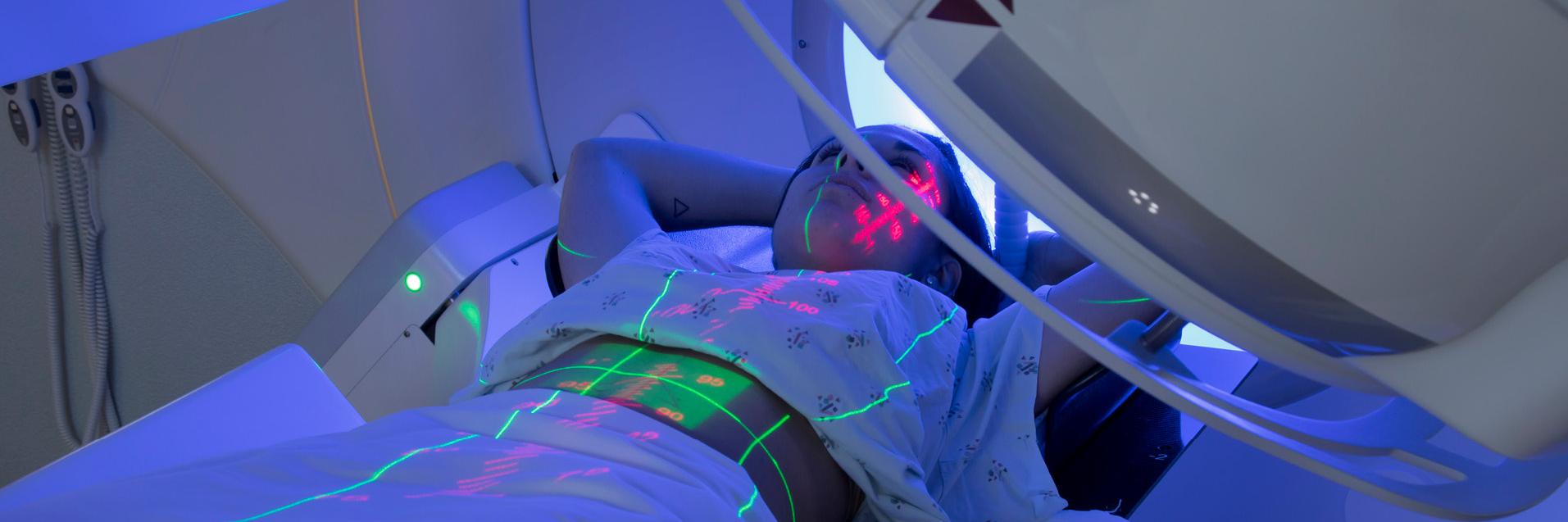
La radiothérapie utilise des rayonnements ionisants pour tuer les cellules cancéreuses en endommageant leur ADN. Le processus de mort des cellules cancéreuses et leur élimination par l'organisme ont lieu quelque temps après l'exposition aux rayonnements ionisants, c'est-à-dire que la mort des cellules cancéreuses n'est pas immédiate. Il existe deux principaux types de radiothérapie en fonction de la manière dont le rayonnement est délivré : les sources de rayonnement sont amenées à proximité des cellules cancéreuses (curiethérapie) ou le rayonnement est dirigé vers les cellules cancéreuses à partir de l'extérieur du corps (radiothérapie externe).
Curiethérapie
Dans la curiethérapie, les sources de rayonnement sont placées à l'intérieur ou à côté de la tumeur. Cela permet de délivrer une plus forte dose de rayonnement aux cellules cancéreuses tout en minimisant les dommages aux tissus sains.
Aspects généraux de la curiethérapie
Délivrée dans les lumières du corps, par exemple les vaisseaux
Délivrée dans les cavités naturelles du corps ou dans des cavités générées par la chirurgie
Délivrée à travers la peau du patient, par exemple à l'aide de dispositifs ressemblant à des aiguilles
Radiothérapie externe
Dans la radiothérapie externe, des rayons X à haute énergie ou des faisceaux de particules sont dirigés vers la tumeur depuis l'extérieur du corps. La précision de la localisation du faisceau et le contrôle de son intensité sont essentiels pour fournir un traitement efficace qui réduit les dommages aux tissus sains environnants. Les ensembles de données suivants concernent des aspects spécifiques de la radiothérapie externe :
L'irradiation est guidée en temps réel à l'aide d'images médicales
Radiothérapie guidée par image
Adaptation des paramètres de traitement aux modifications de l'anatomie du patient ou aux traitements antérieurs
Modulation de l'intensité du faisceau à l'aide, par exemple, de collimateurs multilames
Radiothérapie à modulation d'intensité (IMRT)
Modulation de l'intensité du faisceau lors du déplacement d'un portique
Arcthérapie avec modulation d'intensité (IMAT)
Utilisation de faisceaux de protons ou d'ions
Radiothérapie utilisant des particules chargées
Les particules sont générées par l'irradiation de la cible par la lumière laser
Génération de faisceaux de particules à l'aide de lasers
Radiothérapie à ultra-haut débit de dose, c'est-à-dire supérieure à 40 grays par seconde
Utilisation d'un isotope tel que le bore 10 pour émettre des particules alpha très localisées (NCT)
Thérapie par capture neutronique
Planification de la radiothérapie avec l'IA
L'ensemble de données suivant concerne l'utilisation de l'intelligence artificielle (IA) dans la planification de la radiothérapie afin d'améliorer la précision, l'efficacité et la cohérence de la planification de la radiothérapie, ce qui se traduit par de meilleurs résultats pour les patients. Les algorithmes d'IA peuvent automatiser et améliorer divers aspects du processus de planification, ce qui permet de réduire considérablement le temps nécessaire à la planification.
- Thérapie photodynamique
-
La thérapie photodynamique est un traitement peu invasif qui utilise la lumière et un photosensibilisateur pour tuer les cellules cancéreuses. Le photosensibilisateur est administré aux cellules cancéreuses, par exemple par injection dans la circulation sanguine ou par application sur la peau. Après son exposition à une lumière d'une longueur d'onde spécifique, il produit des espèces réactives de l'oxygène qui tuent les cellules cancéreuses.
- Hyperthermie
-
L'hyperthermie est un adjuvant au traitement du cancer et consiste à chauffer les tissus du corps à des températures supérieures aux valeurs physiologiques normales, de l'ordre de 40 à 43°C, qui ne sont pas assez élevées pour détruire directement les cellules. Les appareils d'hyperthermie utilisent des sources d'énergie telles que les ondes radio ou les micro-ondes pour chauffer les cellules cancéreuses. L'hyperthermie est normalement utilisée en association avec (en tant qu'adjuvant de) la radiothérapie et/ou la chimiothérapie.
- Chimiothérapie classique
-
Parce qu'elles ont acquis des mutations génétiques, les cellules cancéreuses sont très prolifératives. Une autre conséquence des mutations génétiques est l'absence de contrôle et de réparation des dommages causés au génome. La chimiothérapie cible les cellules à croissance rapide et induit leur mort par nécrose, apoptose ou autophagie, par exemple par l'induction et l'accumulation de dommages à l'ADN ou par l'inhibition de la division cellulaire. Les ensembles de données suivants concernent des classes d'agents de chimiothérapie.
Agents alkylants et apparentés
Agents non alkylants
Agents non alkylants endommageant l'ADN et inhibiteurs de la topoisomérase
Anti-métabolites
Anti-pyrimidines et analogues de la cytidine
Agents anti-microtubule
- Thérapie ciblée
-
Les recherches menées au cours des dernières décennies ont permis d'élucider les voies de signalisation activées par les mutations des cellules cancéreuses qui favorisent la prolifération de ces cellules, la modification de la différenciation (transition épithélio-mésenchymateuse), l'angiogenèse et la dissémination. Les traitements basés sur ces recherches ciblent les gènes, les protéines ou l'environnement tissulaire spécifiques d'un cancer (y compris les vaisseaux sanguins), qui contribuent à sa croissance et à sa survie. Ces traitements sont plus ciblés et entraînent souvent moins d'effets secondaires que la chimiothérapie. Ces ensembles de données couvrent donc les documents brevets relatifs au ciblage de voies spécifiques activées dans les cellules cancéreuses, ce qui conduit finalement à une réduction de la croissance de la tumeur, voire à son éradication.
Inhibiteurs de protéine kinases
Inhibiteurs de récepteurs protéine kinases
Les récepteurs tyrosine kinases (RTK) jouent un rôle essentiel dans la régulation des processus cellulaires tels que la croissance, la différenciation, le métabolisme et la motilité. Les RTK transmettent les signaux extracellulaires au cytoplasme. Les inhibiteurs des récepteurs tyrosine kinases (R-TKI) réduisent la phosphorylation et donc l'activation de leurs substrats et inhibent la prolifération ou la survie des cellules cancéreuses.
Inhibiteurs de protéine kinases non-récepteurs
Les tyrosine kinases non-récepteurs (NRTK) sont des protéines intracellulaires qui relaient des signaux essentiels à la régulation de l'adhésion ou de la croissance cellulaire. Les inhibiteurs de tyrosine kinases non-récepteurs (NR-TKI) réduisent la phosphorylation et donc l'activation de leurs substrats et bloquent par conséquent l'activation des voies de signalisation en aval qui favorisent la survie ou la prolifération des cellules cancéreuses.
Inhibiteurs de sérine/thréonine kinases
Les sérine/thréonine kinases jouent un rôle essentiel dans la régulation de la croissance et de la division cellulaires.
Inhibiteurs des kinases Aurora
Inhibiteurs de la voie Hedgehog
Les inhibiteurs de la voie Hedgehog (Hh), tels que le sonidegib, le vismodegib, le glasdegib ou le trioxyde d'arsenic, sont des médicaments qui inhibent la signalisation Hh hyperactivée, laquelle est impliquée dans la carcinogenèse et/ou l'auto-renouvellement des cellules souches cancéreuses dans les cancers de la peau, du cerveau, du foie, de la prostate et du sein, ainsi que dans les hémopathies malignes.
Inhibiteurs de la voie Hedgehog
Inhibiteurs MDM2
Les inhibiteurs MDM2 ont des effets antitumoraux sur les cancers dont le gène TP53, qui code pour le suppresseur de tumeur p53, est de type sauvage ou fonctionnel. Le suppresseur de tumeur est activé par un stress cellulaire ou une lésion de l'ADN. Cela peut conduire à l'arrêt du cycle cellulaire, à la réparation de l'ADN et à l'apoptose, mais dans les cellules tumorales, p53 est souvent régulé à la baisse, par exemple par la surexpression du gène MDM2 et l'accumulation de la protéine MDM2, qui favorise la dégradation de p53. Les inhibiteurs MDM2 tels que l'idasanutlin, la navtemadlin et la siremadlin réactivent p53, exerçant ainsi une forte activité antitumorale.
Inhibiteurs du protéasome
Les inhibiteurs du protéasome (IP) induisent l'accumulation de protéines dépliées et mal repliées dans les cellules, ce qui entraîne l'arrêt de la croissance, l'apoptose et la mort cellulaire. Les cellules cancéreuses peuvent avoir une teneur plus élevée en protéines anormales que les cellules normales et sont plus sensibles aux IP (par exemple bortezomib, ixazomib ou carfilzomib).
Inhibiteurs de PARP
Les inhibiteurs de PARP sont des médicaments qui inhibent les poly(ADP-ribose) polymérases (PARP), enzymes impliquées dans la réparation des cassures simple brin de l'ADN. Ils empêchent la réparation des lésions de l'ADN dans les cellules cancéreuses. L'instabilité génomique des cellules tumorales explique, au moins partiellement, la sélectivité des inhibiteurs de PARP pour les cellules tumorales par rapport aux cellules normales.
Inhibiteurs des protéines liées à l'apoptose
Les membres anti-apoptotiques de la famille BCL-2, BCL-2, BCL-XL, MCL-1 et BCL-w, sont des protéines pro-survie et des cibles établies ou potentielles de la thérapie anticancéreuse dans certaines hémopathies malignes. Il a été démontré que l'inhibition de ces protéines pro-survie avait des effets anticancéreux efficaces, par exemple le venetoclax dans la LLC, la leucémie myéloïde aiguë ou le LDGCB.
Inhibiteurs des protéines de la famille BCL-2 liées à l'apoptose
Inhibiteurs GTPAse K-RAS
K-Ras est un oncogène activé dans les cellules tumorales qui induit une prolifération cellulaire incontrôlée.
Inhibiteurs épigénétiques
L'expression des gènes peut être modulée dans les cellules cancéreuses par la modulation épigénétique, c'est-à-dire la modification de l'accessibilité de l'ADN génomique, par exemple par méthylation ou acétylation. Cette modification peut entraîner l'activation de gènes contrôlant la prolifération cellulaire. Les inhibiteurs épigénétiques visent à stopper cette activation. Par exemple, les inhibiteurs épigénétiques de l'histone méthyltransférase "enhancer of zeste homolog 2" (EZH2) entraînent une régression des tumeurs par l'inhibition de la triméthylation de H3K27.
Inhibiteurs de l'angiogenèse
Les cellules cancéreuses induisent la formation de nouveaux vaisseaux sanguins (angiogenèse) qui fournissent les nutriments nécessaires à leur croissance et entraînent la propagation des cellules tumorales qui s'infiltrent dans les vaisseaux sanguins. Les inhibiteurs de l'angiogenèse empêchent la formation de nouveaux vaisseaux sanguins et sont particulièrement efficaces contre les tumeurs solides, qu'ils privent de sang.
- Thérapie hormonale
-
Les hormones sont des protéines ou de petites molécules appelées messagers chimiques qui coordonnent et contrôlent le fonctionnement des organes du corps. Certaines hormones agissent comme des facteurs de croissance et augmentent la croissance du cancer, comme dans le cas du cancer du sein ou de la prostate. Les recherches suivantes concernent diverses classes de composés qui antagonisent ou régulent les hormones produites par l'organisme.
- Immunothérapie
-
Les cellules cancéreuses se distinguent des tissus sains par la présence de protéines mutées ou de protéines exogènes, par exemple des oncogènes viraux. Le système immunitaire peut donc détecter et détruire les cellules cancéreuses sur la base de ces antigènes ou néoantigènes. Les cellules cancéreuses peuvent échapper au système immunitaire en exprimant des protéines qui bloquent la réponse immunitaire. L'immunothérapie vise à renforcer le système immunitaire pour lutter contre le cancer.
Vaccins
Les vaccins induisent la production d'anticorps et de cellules immunitaires cytotoxiques qui ciblent spécifiquement les cellules cancéreuses. Les vaccins sont basés sur des antigènes spécifiquement exprimés par les cellules tumorales ciblées. Les ensembles de données suivants comprennent des documents brevets généralement liés aux vaccins contre le cancer et sont limités à la nature de l'immunogène ou à la méthode d'administration.
Vaccins à base d'acides nucléiques
Anticorps et immunomodulation
Des anticorps peuvent être administrés au patient pour cibler des molécules spécifiques exprimées à la surface des cellules cancéreuses ou pour activer les cellules immunitaires anticancéreuses. Cet ensemble de données concerne une classe d'anticorps qui bloquent les protéines empêchant le système immunitaire d'attaquer les cellules cancéreuses. Ils renforcent donc l'immunothérapie anticancéreuse.
Inhibiteurs de points de contrôle
Immunothérapie cellulaire, y compris la thérapie cellulaire CAR-T
Cet ensemble de données concerne la modification des cellules immunitaires du patient, souvent des lymphocytes T, afin de cibler des marqueurs spécifiques exprimés à la surface des cellules cancéreuses et d'induire la cytolyse des cellules cancéreuses. Il s'agit notamment de la technologie des cellules CAR-T, particulièrement efficace contre les cancers liquides (leucémie, lymphome, myélome).
Immunomodulateurs
Les recherches suivantes concernent des classes de composés qui stimulent la réponse immunitaire anticancéreuse et favorisent le ciblage des cellules cancéreuses par le système immunitaire du patient :
Antagonistes des récepteurs de l'adénosine
Virus oncolytiques
Les virus oncolytiques sont ceux qui infectent, répliquent et tuent spécifiquement les cellules tumorales, soit naturellement, soit après génie génétique. La combinaison de l'infection virale et de la libération d'antigènes cancéreux par les cellules tumorales tuées stimule une réponse immunitaire anticancéreuse systémique. Cette réponse peut être amplifiée en armant le virus oncolytique d'immunomodulateurs.