BERICHTE NATIONALER RICHTER
RO Rumänien
Petre OHAN - OSIM – Staatliches Amt für Erfindungen und Marken - Direktor der Beschwerdeinstanz - Vorsitzender der Beschwerdekammer - Spezifische Aspekte des Widerrufs im Verwaltungsverfahren im rumänischen Patentrecht (Nr. 64/1991 in der Fassung von 2007)
1. Rechtsvorschriften für den administrativen Widerruf im rumänischen Patentgesetz
1.1 Administrativer Widerruf im rumänischen Patentsystem
Meiner Meinung nach sieht das rumänische Patentgesetz (Nr. 64/1991, in der Fassung von 2007) kein Einspruchs- oder Widerrufsverfahren vor, das mit denen anderer Patentsysteme vergleichbar wäre.
In Artikel 52, 53 und 56 des Patentgesetzes heißt es jedoch:
"Jedermann kann beim OSIM innerhalb von sechs Monaten nach der Veröffentlichung des Hinweises auf die Erteilung des Patents aus einem triftigen Grund schriftlich den Widerruf des Patents beantragen" (Artikel 52).
"…[Ü]ber den Widerrufsantrag … entscheidet eine Beschwerdekammer der Beschwerdeabteilung des OSIM innerhalb von drei Monaten nach Eingang des Antrags" (Artikel 53).
"Bevor ein Patent widerrufen wird …, ist dem Patentinhaber Gelegenheit zu geben, zu dem Widerrufsantrag Stellung zu nehmen … und innerhalb einer angemessenen Frist gesetzlich zulässige Änderungen oder Berichtigungen an der Anmeldung vorzunehmen" (Artikel 56).
Ist meine Behauptung demnach stichhaltig?
Dieses so genannte "Widerrufsverfahren" vor der Patentbeschwerdekammer des rumänischen Patentamts (OSIM) ist de facto eine Kombination aus einem der Erteilung nachgeschalteten Einspruchs- und einem zweiseitigen Beschwerdeverfahren.
Typisches der Erteilung nachgeschaltetes Einspruchsverfahren in einem nationalen Patentamt:
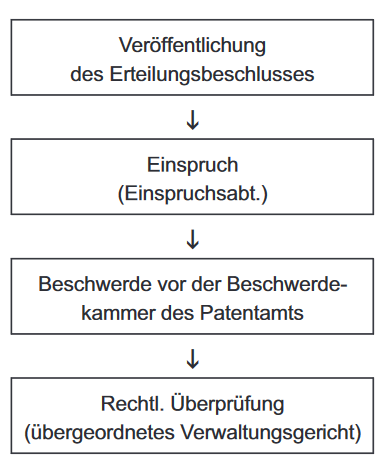
Widerrufsverfahren im OSIM:
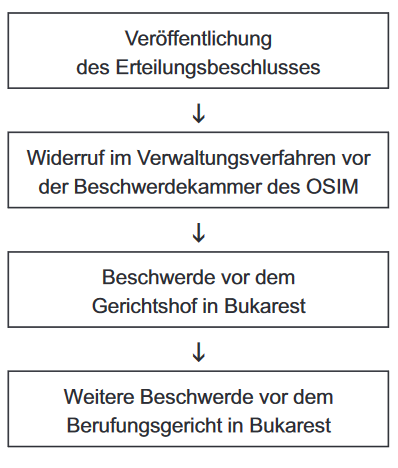
Merkmale:
- Für die Stellung eines Widerrufsantrags vor dem OSIM durch interessierte Personen gilt eine Frist von sechs Monaten.
- Dem Patentinhaber muss Gelegenheit gegeben werden, sein Patent zu verteidigen; es handelt sich also um ein zweiseitiges Verfahren.
- Für die Entscheidung über den Widerrufsantrag ist die Patentbeschwerdekammer des OSIM zuständig.
- Die Patentbeschwerdekammer setzt sich zusammen aus
- einem Vorsitzenden + einem Berichterstatter + einem rechtskundigen Mitglied der Beschwerdeabteilung sowie
- zwei technisch vorgebildeten Mitgliedern der Patentabteilung.
- Wird dem Antrag stattgegeben, so wird das Patent mit Wirkung ex tunc widerrufen.
1.2 Nichtigkeit
Vom OSIM erteilte Patente und europäische Patente mit Wirkung in Rumänien können nur vom Städtischen Gerichtshof in Bukarest für nichtig erklärt werden.
Gegen ein vom OSIM erteiltes Patent kann Nichtigkeitsklage erhoben werden, wenn die Frist zur Beantragung des Widerrufs abgelaufen ist (Artikel 55).
Aufgrund dieser Vorschrift kommt der Widerruf [im Verwaltungsverfahren] im rumänischen Recht einer "frühen Nichtigkeitsklage" gleich, für die das OSIM zuständig ist.
Was das Verhältnis von europäischem Beschränkungsverfahren und rumänischem Beschränkungs- und Widerrufsverfahren betrifft, so verfügt das OSIM bislang noch über keine praktischen Erfahrungen auf diesem Gebiet, doch werden die rumänischen Gerichte bei parallelen Verfahren vermutlich die Aussetzung des Verfahrens beschließen.
Das OSIM ist nicht zuständig für die Beschränkung oder den Widerruf von europäischen Patenten mit Wirkung in Rumänien.
2. Der Überprüfungsausschuss in Patentsachen (Patentbeschwerdekammer)
2.1. Doppelfunktion der Beschwerdekammer
Der Überprüfungsausschuss in Patentsachen des OSIM, wie die Beschwerdekammer genannt wird, ist ein Organ mit administrativen und gerichtlichen Aufgaben (administratives Vorverfahren).
Dies ergibt sich daraus, dass die rumänische Patentgesetzgebung zwar Vorschriften für das Verfahren vor dem Überprüfungsausschuss enthält (Regeln 55 bis 59), ergänzend zu den Vorschriften über die gerichtlichen Befugnisse der Kammer jedoch die Bestimmungen der rumänischen Zivilprozessordnung "entsprechend" anzuwenden sind.
Der gerichtliche Charakter der Kammer tritt im zweiseitigen Verfahren deutlicher zutage, wie die Möglichkeit zeigt, dass eine Partei sich nicht nur durch einen zugelassenen Vertreter (Patentanwalt), sondern auch durch einen Rechtsanwalt vertreten lassen kann.
2.2 Zusammensetzung der Kammer
In Widerrufs- und Beschränkungsverfahren tagt die Kammer in folgender Besetzung:
a) Vorsitzender – der Generaldirektor des OSIM oder der Leiter der Beschwerdeabteilung als sein Stellvertreter
b) Berichterstatter – ein technisch vorgebildetes Mitglied der Beschwerdeabteilung
c) zwei technisch vorgebildete Mitglieder – Prüfer der Prüfungsabteilung – mit mindestens 5 Jahren Berufserfahrung
d) ein rechtskundiges Mitglied der Beschwerdeabteilung.
Die Zusammensetzung der Kammer spiegelt die Natur des Verfahrens wider (Kombination von Einspruchs- und Beschwerdeverfahren).
3. Verfahrensrechtliche Aspekte bei einer Beschränkung oder einem Widerruf
Die Kammer wird in Beschränkungsverfahren als zweite Instanz und in Widerrufsverfahren als erste Instanz tätig.
Jedes Beschwerdeverfahren umfasst einen schriftlichen und einen mündlichen Verfahrensabschnitt.
3.1 Schriftlicher Verfahrensabschnitt
Das schriftliche Verfahren beinhaltet:
- die Einreichung der Antragsschrift und ihre Zustellung an den Antragsgegner
- eine schriftliche Stellungnahme des Antragsgegners (Verteidigung) und ihre Zustellung an den Antragsteller.
Alle Beweismittel sind in Schriftform vorzulegen, Zeugenaussagen in Form einer schriftlichen, notariell beglaubigten Erklärung.
Der rumänischen Zivilprozessordnung zufolge kann jeder, der ein berechtigtes Interesse darlegen kann, einem Widerrufsverfahren beitreten.
3.2 Mündliche Verhandlung in allen Angelegenheiten
Das Gesetz schreibt vor, dass die Beschwerdekammer die Beteiligten in jedem Fall anhört, bevor sie über den Fall entscheidet.
Der Überprüfungsausschuss (Patentdirektion) gibt in jedem Fall eine Stellungnahme zu den Argumenten des Antragstellers bzw. der Parteien ab.
3.3 Vorrangige Prüfung von Einwendungen
Zur Beschleunigung des Verfahrens prüft die Beschwerdekammer nach Artikel 127 der Zivilprozessordnung vor der materiellrechtlichen Prüfung des Falls zunächst von Amts wegen oder auf Antrag eines Beteiligten etwaige Einwendungen.
Die häufigsten Einwendungen, mit denen sich die Kammer zu befassen hat, sind:
- verspätete Antragstellung,
- fehlende oder nicht korrekt entrichtete Gebühren,
- mangelndes Rechtsschutzinteresse.
3.4 Rechtsmittel gegen Entscheidungen der Beschwerdekammer
Die begründete Entscheidung der Beschwerdekammer wird den Beteiligten innerhalb von 14 Tagen nach der mündlichen Verhandlung zugestellt und kann innerhalb von 30 Tagen nach der Zustellung vor dem Gerichtshof in Bukarest angefochten werden.
Die Widerrufsentscheidung wird im Amtsblatt für gewerbliche Schutzrechte bekannt gemacht.
Aus technischen Gründen sind die eingebetteten Bilder in diesem Artikel nur in der PDF-Version verfügbar.
Die Entscheidung über das Widerrufsverfahren wird per Abstimmung getroffen. In den meisten Fällen wird die Entscheidung einstimmig gefasst, es kam allerdings auch schon zu Mehrheitsentscheidungen. In diesen Fällen werden gemäß Zivilprozessordnung die abweichenden Meinungen ebenfalls aufgenommen und bei der schriftlichen Entscheidung berücksichtigt. Es handelt sich somit um einen transparenten Entscheidungsprozess, in dem alle Mitglieder ihre Meinung vertreten können. Entscheidungen der Beschwerdekammer werden im Amtsblatt für gewerbliche Schutzrechte bekannt gemacht.
Entscheidet die Beschwerdekammer, dass das Patent mit Änderungen aufrechterhalten wird, so veröffentlicht das OSIM eine neue (geänderte) Patentschrift.
4. Statistische Angaben
| 2006 | 2007 | 2008 | 2009 | 2010 | 2011 |
aus Vorjahren anhängige Beschwerden | 3 | 4 | 10 | 11 | 14 | 9 |
im Laufe des Jahres eingereichte Beschwerden | 23 | 25 | 26 | 33 | 34 | 13 |
erledigte Beschwerden insgesamt, davon | 22 | 19 | 25 | 31 | 39 | 16 |
| 3 | 4 | 9 | 11 | 14 | 9 |
| 19 | 15 | 16 | 20 | 25 | 7 |
Erledigte Beschwerden insgesamt, davon | 22 | 19 | 25 | 31 | 39 | 16 |
stattgegeben | 9 | 3 | 9 | 9 | 16 | 4 |
zurückgewiesen | 13 | 16 | 16 | 21 | 23 | 11 |
sonstiges | 0 | 0 | 0 | 1 | 0 | 1 |
am Jahresende noch anhängige Beschwerden | 4 | 10 | 11 | 13 | 9 | 6 |
5. Einleitung zur Fallstudie CRI 21/2010
5.1. Zusammensetzung der Kammer
Vorsitzender:
Petre Ohan, Ingenieur
Mitglieder:
1. Elena Bondar, PhD, Berichterstatterin im Verfahren (Beschwerdekammer)
2. Cătălina Mihailescu, Ingenieurin (Patentabteilung)
3. Irina Babaligea, Biochemikerin (Patentabteilung)
4. Carmen Solzaru, Justitiarin (Beschwerdekammer)
5.2. Entscheidung der Beschwerdekammer Nr. 212 / 3. Dezember 2010 einschließlich abweichender Meinung (Auszüge aus dem Text siehe Anhang)
Schlagwörter: Widerruf des Patents RO 122 951 vom 7. Februar 2005 im Verwaltungsverfahren: Filmbeschichtete Tablette mit veränderter Wirkstofffreisetzung und entsprechendes Herstellungsverfahren
- Gründe für den Widerrufsantrag:
- Patentschutzbereich geht über den technischen Inhalt der Anmeldung hinaus
- mangelnde Neuheit:
- - Benutzung der Erfindung vor dem Anmeldetag der Patentanmeldung
- - neuheitsschädliche Vorwegnahme
- mangelnde erfinderische Tätigkeit
5.3 Die relevantesten Schriftstücke zum Stand der Technik
- EP A 1 195 160 (D1), Erfindung veröffentlicht am 10. April 2002, offenbarte ein Zweikomponentensystem für die Wirkstofffreisetzung aus der Arzneiform, bestehend aus einer hydrophilen Komponente einschließlich HPMC und einer hydrophoben Komponente
- RO/EP 1 108 424 T2 (D2), veröffentlicht am 20. Juni 2001, betrifft eine Matrixtablette für die retardierte Freisetzung von Trimetazidin als Dihydrochlorid in einer Menge von 35 mg
- Rumänische Marktzulassung Nr. 3976/2003/01-02 vom 26. November 2003.
5.4 Sachverhalt des Verfahrens beim EPA T 1196/08 (Beschwerde nach Einspruch gegen EP 1 108 424), Entscheidung vom 10. November 2010
Der Inhaber von EP 1 108 424 reichte Klage wegen Verletzung des in RO über das Erstreckungssystem validierten Patents RO/EP1 108 424 T2 (D2) gegen SC...GR Romania ein.
Der Interventionsantrag von SC ... GR Romania aufgrund von Artikel 105(1)(a) EPÜ wurde mit der Begründung abgewiesen, dass RO/EP 1 108 424 kein europäisches Patent im Sinne des Münchner Übereinkommens sei.
6. Schlussfolgerung
Der Widerruf im rumänischen Patentsystem unterscheidet sich in einigen Punkten von den entsprechenden Verfahren in anderen nationalen Systemen/im europäischen Patentsystem.
Die Beschwerdekammer des OSIM verfolgt die einschlägige Rechtsprechung des EPA, um sich daran zu orientieren und die rumänische Praxis auf diejenige des EPA abzustimmen.
Zugleich trägt die Kammer den Besonderheiten des rumänischen Patentsystems Rechnung und ist bestrebt, Lösungen zu finden, die den rumänischen Rechtsvorschriften und ihren Erfordernissen entsprechen.
ANHANG
ANHANG
RO RUMÄNIEN
Staatliches Amt für Erfindungen und Marken
Für Erfindungen zuständige Beschwerdekammer
Verfahren CRI 21/2010
1. Zusammensetzung der Kammer
Vorsitzender:
Petre Ohan, Ingenieur
Mitglieder:
1. Elena Bondar, PhD, Berichterstatterin im Verfahren (Beschwerdekammer)
2. Cătălina Mihailescu, Ingenieurin (Patentabteilung)
3. Irina Babaligea, Biochemikerin (Patentabteilung)
4. Carmen Solzaru, Justitiarin (Beschwerdekammer)
2. Entscheidung der Beschwerdekammer Nr. 212 / 3. Dezember 2010 einschließlich abweichender Meinung (Auszüge)
Schlagwörter: Widerruf eines Patents im Verwaltungsverfahren in Rumänien
Gründe für den Widerrufsantrag:
- Patentschutzbereich geht über den technischen Inhalt der Anmeldung hinaus
- mangelnde Neuheit:
- - Benutzung der Erfindung vor dem Anmeldetag der Patentanmeldung
- - neuheitsschädliche Vorwegnahme
- mangelnde erfinderische Tätigkeit
Rumänien
Staatliches Amt für Erfindungen und Marken
Für Erfindungen zuständige Beschwerdekammer
Verfahren CRI 21/2010
Widerruf eines Patents im Verwaltungsverfahren in Rumänien
I. Titel des Patents RO 122 951 vom 7. Februar 2005: Filmbeschichtete Tablette mit veränderter Wirkstofffreisetzung und entsprechendes Herstellungsverfahren
Unabhängige Ansprüche:
Anspruch 1 – Filmbeschichtete Tablette mit veränderter Wirkstofffreisetzung, dadurch gekennzeichnet, dass der Wirkstoff in den 12 Stunden nach Tabletteneinnahme freigesetzt wird, und zwar durch Verwendung der nicht zur Matrix gehörenden Komponenten Hydroxypropylmethylcellulose und hydriertes Baumwollsaatöl in einem Massenverhältnis von 1/0,02 – 0,08, worin die Hydroxypropylmethylcellulose in einem gravimetrischen Verhältnis von höchstens 25 %, vorzugsweise 18,7 % der Tablettenmasse vorhanden ist, eine Viskosität im Bereich von 4 000 – 100 000 cP und eine Korngröße aufweist, bei der 95 % des Materials durch Siebe mit 20 – 50 Maschen, vorzugsweise 99 % des Materials durch ein Sieb mit 40 Maschen gelangt, wobei das hydrierte Baumwollsaatöl in einem Verhältnis von 0,52 – 2 % der gesamten Tablettenmasse und der Wirkstoff höchstens 15 %, vorzugsweise 13,06 % der Tablettenmasse darstellt.
Anspruch 7 – Verfahren für die Herstellung der filmbeschichteten Tablette mit veränderter Freisetzung von Trimetazidindihydrochlorid nach Anspruch 1 – 6, dadurch gekennzeichnet, dass es folgende Schritte umfasst: ... Dieser Anspruch nennt im Wesentlichen die Schritte der Feuchtgranulierung (Mischen der Komponenten, Feuchtgranulierung, Trocknen, Homogenisieren des trockenen Granulats, Komprimieren des pulverisierten Granulats, Suspendieren und Homogenisieren der resultierenden Suspension) sowie die anwendbaren Parameter.
II. Vom Antragsteller angeführte Gründe
1. Zu den unabhängigen Ansprüchen (Anspruch 1 und Anspruch 7) des Patents RO 122 951, Inhaber: SC ... Bukarest, Les ... Frankreich, vertreten durch den zugelassenen Vertreter ..., begründete der Antragsteller seinen Antrag auf Widerruf unter anderem wie folgt:
- Die Patentanmeldung wurde wesentlich geändert, und die Änderungen sind nach Artikel 27(5) des Patentgesetzes 64/1991 in der Fassung von 2007 ("Gesetz") unzulässig, da sie über den Inhalt der ursprünglichen Anmeldung hinausgehen; dieses Argument wurde gemäß den Bestimmungen von Artikel 52(1)c) des Gesetzes angeführt, und
- Nichterfüllung des Neuheitserfordernisses, da
- der Gegenstand der Patentanmeldung a 200 500 886 vom Anmelder vor dem Anmeldetag 7. Februar 2005 öffentlich benutzt wurde;
- der Gegenstand der Erfindung aus der Patentschrift RO/EP 1 108 424 (D2) bekannt war, die der europäischen Patentanmeldung Nr. 00 403 533.3 vom 15. Dezember 2000 mit Priorität FR 9 915 960 vom 17. Dezember 1999 entspricht, in der RO über das Erstreckungssystem angegeben war (Gesetz 32/1997), wobei das neuheitsschädliche Dokument – die europäische Patentanmeldung Nr. 00 308 774.9 vom 5. Oktober 2000, veröffentlicht am 10. April 2002 (auf deren Grundlage das Patent EP 1 195 160 B1 erteilt und am 16. September 2009 veröffentlicht wurde) – als solches oder "als ... in D1 aufgenommenes Dokument" berücksichtigt wird.
- Nichterfüllung des Erfordernisses der erfinderischen Tätigkeit
nach Artikel 12 des Gesetzes und Artikel 46 der Ausführungsordnung und angesichts des folgenden Stands der Technik: RO/EP 1 108 424 (D2), Patent EP-A 1 195 160 (D1) und die entsprechende Patentanmeldung, die Marktzulassung des Produkts Trimetazidina LPH 35 mg und die allgemeinen Kenntnisse der Arzneimitteltechnik.
1.1. Zur Stützung des ersten Grundes zeigte der Antragsteller auf, dass Anspruch 7 technische Merkmale enthielt, die nicht in der ursprünglich eingereichten Beschreibung der Erfindung vorhanden waren, beispielsweise:
- [Feuchtgranulierung] mit 13 Massenanteilen gereinigtes Wasser für maximal 15 min.; auf diese Granulierung folgt eine Trocknung des Granulats in einem Fluidisierungsbad bei einer Temperatur von höchstens 40°C für maximal zwei Stunden (Schritt I);
- Homogenisierungszeit von 35 Minuten sowie Ausgleich von Trocknungsverlusten mit Maisstärke (Schritt ii);
- die Parameter für die Bruchfestigkeit des Kerns bewegen sich zwischen 75 und 110 N, durchschnittliche Kernmasse von 260 mg +/- 5 % (Schritt iii);
- für Schritt iv wurden alle Parameter und Werte nachträglich hinzugefügt.
1.2. Zur Stützung des zweiten Grundes zeigte der Antragsteller auf, dass der Gegenstand, d. h. die Tablette, von Patent RO 122 951 nicht neu war, da sie durch öffentliche Benutzung und Inverkehrbringen als Produkt offenbart worden war.
SC Labormed Pharma S.A. erhielt 2003 die Marktzulassung für das Produkt, das Gegenstand der Ansprüche 1 – 6 ist, und verkauft es seit 2004. Zu diesem Zweck unternahm SC Labormed Pharma S.A. alle erforderlichen Schritte im Rahmen des geltenden Rechts, um einen Produktpreis zu erhalten und das Produkt auf die Liste der subventionierten Arzneimittel zu bringen, führte Werbekampagnen durch und stellte es in Vertriebsnetze ein, die von der Marktzulassung Nr. 3976/2003/01-02 vom 26. November 2003 abgedeckt sind. In der Zulassung werden alle wesentlichen Merkmale des Produkts Trimetazidina LPH 35 mg gemäß den Patentansprüchen 1 – 6 aufgeführt:
"das auf dem Arzneimittelmarkt angebotene Produkt als solches enthält sämtliche Angaben der Ansprüche 1 – 6, die der Öffentlichkeit durch die Benutzung zugänglich gemacht wurden; somit erfüllen die Ansprüche 1 – 6 nicht das Erfordernis der Neuheit am Anmeldetag."
1.3. Zur Stützung des zweiten Grundes ist das technische Problem, das von der in Patent RO 122951 beanspruchten Erfindung gelöst wird, gegenüber den genannten Dokumenten zum Stand der Technik naheliegend im Sinne von Artikel 12(1) des Gesetzes, siehe Artikel 47(10)h) der entsprechenden Ausführungsordnung.
Das von RO 122 951 gelöste technische Problem besteht aus der Herstellung einer Tablette mit dem Wirkstoff Trimetazidindihydrochlorid in einer Konzentration von 35 mg, der in den 12 Stunden nach der Einnahme kontrolliert freigesetzt wird.
Gelöst wird das technische Problem durch Zugabe von zwei Mitteln für die kontrollierte Wirkstofffreisetzung gelöst: Hydroxypropylmethylcellulose (HPMC) und hydriertes Baumwollsaatöl in einem Verhältnis von 50 : 1.
Das am 20. Juni 2001 veröffentlichte Dokument D2 betrifft eine Matrixtablette zur retardierten Freisetzung von Trimetazidin als Dihydrochlorid in einer Menge von 35 mg, worin die retardierte Freisetzung durch Verwendung eines von Cellulose abgeleiteten Polymers kontrolliert wird, das aus Hydroxypropylcellulose, Hydroxyethylcellulose, Hydroxymethylcellulose, Methylcellulose und Hydroxypropylmethylcellulose ausgewählt wird.
Die bevorzugte Formulierung enthält Hydroxypropylmethylcellulose (HPMC), aber auch ein Bindemittel, ein Verdünnungsmittel, ein Schmiermittel und ein Fließmittel. Die Tablette ist zweimal am Tag einzunehmen, und die retardierte Freisetzung erfolgt in den 12 Stunden nach Einnahme; sie soll zur Prophylaxe von Angina pectoris, bei chorioretinalen Anfällen und bei der Behandlung von Schwindel vaskulären Ursprungs angewendet werden.
Das am 10. April 2002 im Europäischen Patentblatt 2002/15 veröffentlichte Dokument D1 betrifft eine pharmazeutische Zusammensetzung zur kontrollierten Freisetzung auf der Basis von Trimetazidindihydrochlorid in Verbindung mit hydrokolloidbildenden Materialien sowie mit hydrierten Ölen.
In der Marktzulassung Nr. 3976/2003/01-02 wird eine qualitative und quantitative Zusammensetzung einer filmbeschichteten Tablette mit veränderter Freisetzung angegeben, die 35 mg Trimetazidindihydrochlorid, HPMC und hydriertes Baumwollsaatöl in einem Verhältnis von 50 : 1,4 umfasst.
Nach geltendem Recht und der üblichen Praxis der Patentprüfung, auch im EPA, ist die erfinderische Tätigkeit mithilfe des Aufgabe-Lösungs-Ansatzes zu prüfen.
- Das wichtigste Element zur Festlegung der kontrollierten Wirkstofffreisetzung und zur Lösung des technischen Problems in RO 122 951 ist HPMC mit einer Viskosität von 100 000 cP, vorzugsweise 4 000 cP, und ein hydriertes Baumwollsaatöl in einem Verhältnis von 50 : 1,4, beides nach dem Stand der Technik bekannt. Die anderen in der Trimetazidindihydrochlorid-Tablette verwendeten Trägermaterialien sind in der Technik bekannt und einschlägigen Fachleuten zugänglich.
- Die in Patent RO 122 951 zur Kontrolle der Wirkstofffreisetzung über 12 Stunden zugesetzten Materialien unterscheiden sich nicht von bereits bekannten und für den gleichen Zweck verwendeten Materialien, wie in den Dokumenten D2 und D1 sowie in der Marktzulassung Nr. 3976/2003/01-02 offenbart.
Da die Wirkstofffreisetzung in Dokument D2 fast identisch mit der in Patent RO 122 951 beschriebenen ist, stellt die Art der technischen Problemlösung in RO 122 951 keinen Fortschritt im betreffenden Fachgebiet gemäß Artikel 16(1)d) der Ausführungsordnung dar. Mit anderen Worten, es hat gegenüber der aus Dokument D2 bekannten technischen Lösung keine erfinderische Tätigkeit stattgefunden.
Was die erfinderische Tätigkeit in Anspruch 7 angeht, ist auch das Verfahren zur Herstellung der Tablette aus Dokumenten zum Stand der Technik bekannt. Die alleinige Festlegung der Werte für die Viskosität und Granularität des HPMC in dem aus Dokument D2 bekannten Bereich stellt keinen Fortschritt oder Beitrag zum Stand der Technik dar.
Daraus folgt, dass Patent RO 122 951 gegenüber dem Stand der Technik keine erfinderische Tätigkeit enthält, da es die naheliegende Verwendung bekannter, für den gleichen Zweck eingesetzter Mittel ohne die Erzielung neuer oder überraschender Wirkungen beschreibt und es deshalb das Erfordernis der erfinderischen Tätigkeit gemäß Artikel 47(9)a) nicht erfüllt.
III. Vom Patentinhaber angeführte Gründe
2. Zur Verteidigung gegen die oben genannten Argumente reichte der Patentinhaber, vertreten durch den zugelassenen Vertreter ..., folgende Stellungnahme ein:
2.1. Der Anwendungsbereich von Anspruch 16 der ursprünglichen Patentanmeldung ist breiter gefasst als der Anwendungsbereich von Anspruch 7 des oben genannten Patents, so dass dieses nicht über den Inhalt der ursprünglichen Patentanmeldung hinausgeht, sondern, im Gegenteil, enger gefasst ist.
a) Im Detail bezieht sich die ursprüngliche Fassung der Patentanmeldung auf Seite 3 Absatz 2 und Seite 4 Absatz 4, 5 und 6 sowie in Anspruch 16 auf die Merkmale des verwendeten technischen Verfahrens, nämlich der Feuchtgranulierung. Die Mischungsverhältnisse der Komponenten sind implizit; sie leiten sich vom bevorzugten Ausführungsbeispiel F1 in der Anmeldung ab. Die Reihenfolge der Zugabe/Mischung der Komponenten ist ebenfalls angegeben. In dem erteilten Patent werden auch andere Elemente des Verfahrens genannt, wie die Wassermenge (die allerdings im Endprodukt nicht vorkommt), die Granulierungszeit, die Temperatur und Dauer der Fließbetttrocknung, die Homogenisierungsdauer, die Härte der Tabletten, die Suspendierung und Homogenisierung des Films und einige andere Parameter des Filmbeschichtungsverfahrens.
b) All diese Details wurden auf Anforderung des OSIM hin aufgenommen und können folglich insofern nicht als Argument dafür angeführt werden, dass sie über den Rahmen der ursprünglichen Anmeldung herausgehen, als sie aus technischer Sicht naheliegende Arbeitsverfahren oder Betriebsparameter beschreiben (die ursprüngliche Anmeldung nennt die Durchführung des Feuchtgranulierungsverfahrens und deckt sowohl die In-vivo- als auch die In-vitro-Profile ab). Jeder Fachmann im Bereich Arzneimitteltechnik weiß, dass die Feuchtgranulierung nicht länger als 1 h dauern darf, die Fließbetttrocknung 75 – 100 °C nicht übersteigen darf, die Presse der Rotiermaschine auf einen bestimmten Wert eingestellt werden muss, um eine Bruchfestigkeit der Tabletten von unter 150 N zu gewährleisten, der Beschichtungsfilm suspendiert und homogenisiert werden muss, die Filmbeschichtungstemperatur nicht über der Verdampfungstemperatur des Suspensionsmittels liegen darf etc." "Die Engerfassung ..." erfolgte mit Bezug auf höhere, im Bereich der pharmazeutischen Formulierungen allgemein bekannte implizite Grenzen. In Beispiel 6, nämlich die Freisetzungskinetik in vivo, wird nur ein Merkmal des gemäß dem Patent hergestellten Produkts angegeben (die bevorzugte Formel F1).
c) Wie die Lehre zeigt, müssen die Möglichkeiten zur Änderung von Patentanmeldungen auf bestimmte, ausdrücklich im Gesetz genannte Fälle beschränkt sein, um die Rechtssicherheit des Patents insbesondere Dritten gegenüber zu gewährleisten. In diesem Sinn ist Artikel 27(5) des Gesetzes so zu verstehen, dass die Änderungen nicht über den Inhalt der Anmeldung am Anmeldetag hinausgehen dürfen, d. h. dass sie nicht über den ursprünglichen Gegenstand der Anmeldung hinausgehen dürfen. Hingegen sind Änderungen zulässig, die den beantragten Schutzbereich verkleinern. Somit sind im vorliegenden Fall die Bedingungen von Artikel 27(5) des Patentgesetzes 64/1991 vollständig erfüllt.
Die Daten in Beispiel 6 und Figur 2 sind pharmakokinetische Parameter aus In-vivo-Versuchen, die implizit in der ursprünglichen Anmeldung enthalten sind, da die Versuchsergebnisse aus dem Jahr 2004 stammen, bevor die Patentanmeldung beim OSIM eingereicht wurde, und in der bei der National Medicines Agency (NMA) eingereichten Bioäquivalenzstudie darauf Bezug genommen wird.
2.2. Verteidigung der Neuheit
2.2.1. Anspruch 1 von RO 122 951 gegenüber Anspruch 1 von RO/EP 1 108 424 (D2)
RO 122951 | EP 1108424 (D2) |
|---|---|
Filmbeschichtete komprimierte Tablette mit veränderter Wirkstofffreisetzung, die 35 mg Trimetazidindihydrochlorid enthält |
Matrixtablette für eine retardierte Freisetzung von Trimetazidin oder einem seiner pharmazeutisch annehmbaren Salze |
Die Wirkstofffreisetzung erfolgt durch die Verwendung von zwei nicht zur Matrix gehörenden Komponenten: Hydroxypropylmethylcellulose (HPMC) und hydriertes Baumwollsaatöl |
Die retardierte Freisetzung wird durch die Verwendung einer einzigen Komponente kontrolliert: eines von Cellulose abgeleiteten Polymers in der Matrix, das aus Hydroxypropylcellulose, Hydroxyethylcellulose, Hydroxymethylcellulose, Methylcellulose und Hydroxypropylmethylcellulose ausgewählt wird. |
Der Inhalt, die Granularität und die Viskosität des HPMC haben einen Einfluss auf die Wirkstofffreisetzungskinetik. |
Der Inhalt, die Granularität und die Viskosität des HPMC haben keinen Einfluss auf die Wirkstofffreisetzungskinetik. |
Das Verhältnis HPMC : hydriertes Öl in dem beanspruchten Produkt beträgt 1:0,02 ... 1:0,08 und hat einen Einfluss auf die verzögerte Trimetazidinfreisetzung aufgrund der spezifischen Synergien der Kombination von HPMC und hydriertem Öl. |
Hydriertes Baumwollsaatöl ist im beanspruchten Produkt nicht vorhanden. Die retardierte Trimetazidinfreisetzung wird durch die Wirkung einer einzigen Komponente erzielt, die aus Hydroxypropylcellulose, Hydroxyethylcellulose, Hydroxymethylcellulose, Methylcellulose und Hydroxypropylmethylcellulose ausgewählt wird. |
- RO 122 951 beansprucht den Schutz einer neuen Zusammensetzung, die eine verzögerte Wirkstofffreisetzung bewirken kann.
- Ein wesentlicher Unterschied zwischen Anspruch 7 (Verfahrensanspruch) in Patent RO 122 951 und Anspruch 16 (Verfahrensanspruch) in D2 besteht darin, dass die Kontrolle der verzögerten Wirkstofffreisetzung aufgrund von zwei Verbindungen erfolgt, während sie im Verfahren in D2 aufgrund von einer einzigen Verbindungsklasse erfolgt.
- In RO 122 951 hängt das Profil der anhaltenden Wirkstofffreisetzung von dem Massenverhältnis zwischen HPMC und hydriertem Öl sowie von der Granularität und Viskosität des HPMC ab.
- In D2 hängt die Kontrolle der Freisetzung von Trimetazidindihydrochlorid von einem einzigen Kontrollmittel ab.
Die Wirkstoffmenge in der Formulierung und die Menge des Freisetzungskontrollmittels sind in beiden Dokumenten komplementär: Das Trimetazidindihydrochlorid ist in RO 122 951 in einem Verhältnis von höchstens 15 % der Tablettenmasse vorhanden, während es in D2 in einem Verhältnis von 15 – 30 % der Tablettenmasse vorhanden ist; das HPMC ist in RO 122 951 in einem Verhältnis von höchstens 25 %, vorzugsweise 18,7 % der Tablettenmasse vorhanden, während es in D2 in einem Verhältnis von 25 – 50 % der Tablettenmasse vorhanden ist.
- Beide Verfahren verwenden zwar die Feuchtgranulierung, doch wird sie auf verschiedene Produkte angewendet: In RO 122 951 wird sie zur Herstellung eines anderen Produkts als in D2 verwendet.
2.2.2. Zwar hat der Inhaber das Produkt Trimetazidine 35 mg LPH vor dem Anmeldetag der Patentanmeldung Nr. a 200 500 086 in Verkehr gebracht, doch ist diese Benutzung nicht neuheitsschädlich, da sie unter Wahrung des Geschäftsgeheimnisses erfolgte.
Dabei wird Bezug genommen auf:
- Artikel 726(4) des Gesetzes 95/2006 bezüglich der Reform im Bereich der öffentlichen Gesundheit: Die NMA macht den Bericht zusammen mit ihren Entscheidungsgründen der Öffentlichkeit zugänglich, außer im Falle vertraulicher Geschäftsinformationen.
- Artikel 5 des Gesetzes 11/1991 gegen den unlauteren Wettbewerb: Die Offenbarung von Informationen über Versuchsergebnisse ist untersagt.
- Artikel 39 des TRIPS-Übereinkommens: Zur Sicherung eines wirksamen Schutzes gegen unlauteren Wettbewerb sind geheime Informationen mit wirtschaftlichem Wert zu schützen, die bei Regierungen oder Regierungsbehörden zur Erlangung der Marktzulassung pharmazeutischer Erzeugnisse eingereicht werden.
2.3. Verteidigung der erfinderischen Tätigkeit
- Die in Patent RO 122 951 beanspruchte Erfindung umfasst eine erfinderische Tätigkeit, da sie eine Verwendung der technischen Mittel der beanspruchten Erfindung betrifft, durch die der Fachmann ein technisches Problem auf andere Weise lösen kann als in den untersuchten Dokumenten zum Stand der Technik beschrieben (Artikel 47(9)f) der Ausführungsordnung).
- Die in RO 122 951 beschriebene technische Lösung ist ein anderer Weg der Zuordnung von Hilfsstoffen unter bestimmten Bedingungen, um die Freisetzung des Trimetazidindihydrochlorids in Arzneiform zu regulieren, wodurch ein neues Produkt mit den bekannten Verwendungseigenschaften entsteht, das durch Robustheit und Flexibilität gekennzeichnet ist.
- Somit erfolgt die Kontrolle der verzögerten Wirkstofffreisetzung aufgrund von zwei Verbindungen, nämlich HPMC und hydriertem Baumwollsaatöl (in einem bestimmten Massenverhältnis, mit einer bestimmten Granularität und Viskosität), wobei die Zuordnung für einen Fachmann nicht naheliegend ist.
IV. Einschlägige Rechtsvorschriften
3.1. Bezüglich der Gründe für den Widerruf eines Patents und der Offenbarung der Erfindung bei der vorschriftsmäßigen Anmeldung regelt das Gesetz Folgendes:
"(1) Jedermann kann beim OSIM innerhalb von sechs Monaten nach der Bekanntmachung des Hinweises auf die Erteilung des Patents aus einem triftigen Grund schriftlich den Widerruf des Patents beantragen, wenn:
a) der Gegenstand des Patents nach Artikel 7 – 10, 12 und 13 nicht patentfähig ist;
b) der Gegenstand des Patents die Erfindung nicht so hinreichend deutlich und vollständig offenbart, dass ein Fachmann sie ausführen kann;
c) der Gegenstand des Patents über den Inhalt der eingereichten Patentanmeldung hinausgeht.
(2) Beziehen sich die Widerrufsgründe nur auf einen Teil des Patents, so wird das Patent teilweise widerrufen" (Artikel 52 des Patentgesetzes 64/1991 in der Fassung von 2007).
3.2. Zur Zulässigkeit von Änderungen der Patentanmeldung nach der vorschriftsmäßigen Hinterlegung regelt das Gesetz Folgendes:
"Auf Anforderung des OSIM oder von sich aus kann der Anmelder [...], bevor eine Entscheidung getroffen wird, die Patentanmeldung ändern, sofern die Offenbarung der Erfindung nicht über den Inhalt der Patentanmeldung am Anmeldetag hinausgeht" (Artikel 27(5) des Patentgesetzes 64/1991 in der Fassung von 2007).
Diese Bestimmungen werden in Artikel 37(6)b) des Regierungsbeschlusses 547 von 2008 erläutert:
"Änderungen durch den Anmelder oder zugelassenen Vertreter während der Vor- oder Sachprüfung sind vom OSIM anzunehmen, wenn sie:
[...]b) sich auf den Inhalt der Ansprüche beziehen, jedoch auf Merkmalen basieren, die in der Beschreibung und den Zeichnungen der vorschriftsmäßigen nationalen Anmeldung enthalten sind;"
3.3. Zur Offenbarung der Erfindung durch Benutzung vor dem Anmeldetag der Patentanmeldung regelt das Gesetz Folgendes:
"(1) Eine Erfindung gilt als neu, wenn sie nicht zum Stand der Technik gehört.
(2) Der Stand der Technik umfasst alle Kenntnisse, die vor dem Anmeldetag der Patentanmeldung durch schriftliche oder mündliche Beschreibung, durch Benutzung oder in sonstiger Weise der Öffentlichkeit zugänglich gemacht worden sind." (Artikel 10 des Patentgesetzes 64/1991 in der Fassung von 2007)
Diese Bestimmungen werden in Artikel 38(8) des Regierungsbeschlusses 547 von 2008 erläutert:
"Die Informationen gelten als der Öffentlichkeit durch Benutzung zugänglich gemacht im Sinne von Artikel 10 Absatz (2) des Gesetzes, wenn jedermann zum betreffenden Zeitpunkt durch die Darstellung oder Benutzung Kenntnis davon erlangen kann. Verkauft eine Person einen Gegenstand ohne Einschränkungen oder Geheimhaltungsverpflichtungen an Dritte, so gilt der Gegenstand als der Öffentlichkeit zugänglich gemacht."
V. ENTSCHEIDUNG DER BESCHWERDEKAMMER Nr. 212
3. Dezember 2010
V.1. Erweiterung über die ursprüngliche Anmeldung hinaus durch Hinzufügen neuer Parameter in Anspruch 7 (Verfahrensanspruch).
- Die Kammer entschied, Anspruch 7 dahingehend zu ändern, dass alle Parameter aus dem Text entfernt werden, die von der ursprünglichen Beschreibung nicht gestützt werden (Suspendierungszeit, Menge des gereinigten Wassers, Viskosität der resultierenden Suspension, Drehzahl der Trommel, Befüllungsgeschwindigkeit der Suspension, Druck und Temperatur im Tablettenbett, Anteil der Natriumcarboxymethylcellulose).
Von der Kammer geänderter Anspruch 7:
„7. Verfahren für die Herstellung der filmbeschichteten Tablette mit veränderter Freisetzung von Trimetazidindihydrochlorid nach Anspruch 1 – 6, dadurch gekennzeichnet, dass es folgende Schritte umfasst:
i. Mischen von 35 Anteilen Trimetazidindihydrochlorid mit 100 Anteilen Mannitol, 51,5 Anteilen Stärke und 9 Anteilen Polyvinylpyrrolidon, Feuchtgranulierung mit gereinigtem Wasser und Trocknen im Fluidisierungsbad;
ii. Homogenisierung des getrockneten und klassifizierten Granulats während 35 Minuten mit 50 Anteilen Hydroxypropylmethylcellulose mit einer Viskosität von 15 000 cP und einer Korngröße, bei der 99 % des Materials durch das Sieb mit 40 Maschen gelangt, 1,4 Anteilen hydriertem Baumwollsaatöl, 4,2 Anteilen kolloidalem Siliciumdioxid, 6,3 Anteilen Talkum, 2,6 Anteilen Magnesiumstearat und der durch Trocknungsverluste entstehenden Differenz von bis zu 260 Anteilen, die mit Maisstärke ausgeglichen wird;
iii. Komprimieren des pulverisierten Granulats in einer Drehkompressionsmaschine, so dass die resultierenden Kerne eine Bruchfestigkeit in Durchmesserrichtung zwischen 75 und 110 N und eine mittlere Masse von 260 mg +/- 5 % aufweisen.
iv. Suspendieren und Homogenisieren der Suspension durch die Zugabe von 8 Anteilen eines Filmbeschichtungsmittels in gereinigtes Wasser, wobei die Filmbeschichtung unter an sich bekannten Bedingungen mit Natriumcarboxymethylcellulose als Filmbeschichtungsmittel erfolgt."
V.2. Beispiel 6 zeigt das Profil der In-vivo-Freisetzung des Wirkstoffs, bei dem die pharmakokinetischen Parameter der bevorzugten Formulierung der Erfindung hervorgehoben sind.
Figur 2 ist eine – allerdings nicht in der ursprünglichen Anmeldung enthaltene – grafische Darstellung der mittleren Plasmakonzentration für die bevorzugte Formulierung der Erfindung.
All diese Angaben können in der Beschreibung der Erfindung bleiben, da sie ein besseres Verständnis der Erfindung ermöglichen sollen, ohne den Schutzbereich des Patents zu berühren.
V.3. Bei der Prüfung der Neuheit berücksichtigte die Kammer Folgendes:
Das relevanteste Dokument zum Stand der Technik, das zur Prüfung der Neuheit des Patents herangezogen wird, ist EP A 1 195 160 (D1), denn:
a. D1 war zum Zeitpunkt der regelmäßigen nationalen Einreichung der Patentanmeldung a 200 500 086 am 7. Februar 2005 bereits ein öffentliches Dokument (Veröffentlichung am 10. April 2002). Das am 16. September 2009 veröffentlichte Patent EP 1 195 160 existierte damals noch nicht.
b. - D1 enthält ein Zweikomponentensystem für die Wirkstofffreisetzung aus der Arzneiform, bestehend aus einer hydrophilen Komponente einschließlich HPMC und einer hydrophoben Komponente aus Fettsäuren, Fettalkoholen und hydriertem Öl zur retardierten Freisetzung von Trimetazidin über einen Zeitraum von bis zu 24 h, vorzugsweise 18 h (Anspruch 15) und mindestens 12 h (Anspruch 15) nach oraler Einnahme.
Das hydrierte Öl ist nach den Ansprüchen zusammen mit dem HPMC ein wesentliches Merkmal der Erfindung. In D1 ist das System zur kontrollierten Wirkstofffreisetzung ein Zweikomponentensystem, das neben HPMC hydrierte Öle umfassen kann.
In RO/EP 1 108 424 T2 (D2) erfolgt die Wirkstofffreisetzung durch eine einzige Komponente, nämlich HPMC.
Die Kammer stellte fest, dass D2 die hydrophobe Komponente nicht umfasst, die ein wesentliches Merkmal der Erfindung in RO 122 951 darstellt.
Somit befand die Kammer, dass die Prüfung der Neuheit korrekt anhand von Dokument D1, das mehr wesentliche Merkmale der Erfindung als D2 enthält, durchgeführt worden war.
V.3.2. Zur Prüfung der Neuheit anhand der Dokumente in der vom Inhaber zur Erlangung der Marktzulassung Nr. 3976/2003/01-02 vom 26. November 2003 eingereichten Zulassungsakte stellte die Kammer Folgendes fest:
V.3.2.1. Die Marktzulassung der NMA stellt eine vorläufige Zulassung zum Inverkehrbringen des Produkts Trimetazidine 35 mg dar. Die Zulassung erfolgte vor dem Anmeldetag der Patentanmeldung und gibt die quantitative und qualitative Zusammensetzung des Produkts Trimetazidine an, ohne alle wesentlichen Merkmale der filmbeschichteten Tablette oder das entsprechende Herstellungsverfahren zu nennen, die Gegenstand der Ansprüche sind.
Ort und Zeitpunkt der Veröffentlichung der Zulassungsakte sind in den Anlagen zur Marktzulassung (Patienteninformation – Trimetazidine 35 mg, Zusammenfassung der Produktmerkmale, Angaben in Beschriftungen) nicht deutlich angegeben.
In den genannten Auszügen aus dem NMA-Bulletin wird der Antrag auf Marktzulassung und deren Erteilung nur einmal erwähnt. Die Auszüge geben nicht alle Dokumente der Zulassungsakte in extenso wieder, die für die Marktzulassung des Produkts erforderlich waren.
Laut Bioäquivalenzstudie zum Nachweis darüber, dass das Produkt Trimetazidine LPH 35 mg (generisches Produkt) die gleiche biopharmazeutische Wirkung zu erzeugen vermag wie das Produkt Preductal 35 mg (Referenzprodukt), wurde die gesamte Dokumentation bei der NMA unter der Bedingung der Vertraulichkeit gemäß einer Geheimhaltungsvereinbarung zwischen NMA und Produkteigentümer eingereicht.
Somit befand die Kammer, dass die Dokumente in der Zulassungsakte nach Artikel 38(9) des Regierungsbeschlusses 547/2008 nicht öffentlich waren, außer den ersten drei Anlagen zur Marktzulassung: "Kenntnisse, die der Öffentlichkeit mündlich, durch Benutzung oder auf andere Weise zugänglich gemacht wurden, gelten nur dann als zum Stand der Technik gehörig, wenn in einem datierten Dokument auf ihre Existenz Bezug genommen und der Zeitpunkt genannt wurde, an dem es der Öffentlichkeit zugänglich gemacht wurde."
Dennoch hat die Kammer diese vom Antragsteller eingereichten Dokumente analysiert.
So stellte die Kammer fest, dass die Patienteninformation (Teil der Marktzulassung) und die Zusammenfassung der Produktmerkmale weder Angaben über das Zweikomponentensystem zur Wirkstofffreisetzung noch Angaben über das Herstellungsverfahren für die filmbeschichtete Tablette offenbaren.
Die Marktzulassung umfasst zwar Angaben über die qualitative und quantitative Zusammensetzung des Produkts, doch beschreibt sie nicht die besonderen Merkmale des HPMC (Viskosität und Granularität) oder die Verfahrensschritte zur Herstellung der filmbeschichteten Tabelle, die Gegenstand der Ansprüche sind.
Die endgültige Marktzulassung für das Produkt Trimetazidine 35 mg LPH wurde am 30. Mai 2005 erteilt (nach dem Anmeldetag der Patentanmeldung).
Im Protokoll über die Bioäquivalenzstudie bezüglich einer Einfach- oder Mehrfachgabe des Produkts Trimetazidine LPH 35 mg im Vergleich zu dem Produkt Vastarel 35 mg und dem Produkt Preductal fand die Kammer Angaben über die Dosierung des getesteten Medikaments in Form der Einfach- und Mehrfachgabe, das angewandte Verfahren und die freiwilligen Testteilnehmer.
Der In-vitro-Lösungstest legt die Beschaffenheit des generischen Medikaments der beanspruchten Tablette dar, ohne die Neuheitselemente nach den Ansprüchen von RO 122951 zu offenbaren.
Aufgrund der vorstehenden Analyse befand die Kammer, dass die vom Antragsteller als Beleg für mangelnde Neuheit eingereichten Dokumente nicht die wesentlichen technischen Merkmale der filmbeschichteten Tablette enthielten, die Gegenstand von Patent RO 122 951 ist.
V.3.2.2 Zur fehlenden Neuheit der filmbeschichteten Tablette infolge deren Benutzung vor dem Anmeldetag
befand die Kammer gemäß Artikel 38(8) und 38(9) des Regierungsbeschlusses 547/2008 Folgendes:
- Das Produkt wurde der Öffentlichkeit zwar vor dem Anmeldetag (7. Februar 2005) durch Verkauf zugänglich gemacht, doch offenbart die Patienteninformation zu dem Produkt die physikalischen und chemischen Merkmale des Systems für die kontrollierte Wirkstofffreisetzung nicht vollständig.
- Obgleich das Produkt in Verkehr gebracht wurde, so dass Dritte die Zusammensetzung der filmbeschichteten Tablette durch eine quantitative und qualitative Analyse hätten bestimmen können, hätten sie die physikalischen Merkmale der Tablettenkomponenten, die für die Wirkstofffreisetzung verantwortlich sind, nicht reproduzieren können. Darüber hinaus hat der Antragsteller der Kammer außer der Patienteninformation keine Tests oder Laboranalysen der filmbeschichteten Tablette zur Verfügung gestellt, die vor dem Anmeldetag der Patentanmeldung a 2005 00886 durchgeführt wurden und die inhärenten Merkmale der Tablettenkomponenten hätten belegen können.
Daher befand die Kammer, dass das Produkt nicht vollständig der Öffentlichkeit zugänglich gemacht worden war.
Somit stellte die Kammer mehrheitlich fest, dass die Bedingungen von Artikel 10 des Patentgesetzes 64/1991 in der neuen Fassung erfüllt wurden.
V.4. Zur erfinderischen Tätigkeit stellte die Kammer Folgendes fest:
- D2 betrifft eine pharmazeutische Zusammensetzung mit einem Einkomponentensystem für die kontrollierte Wirkstofffreisetzung, das nur HPMC (Matrixkomponente) umfasst. Somit betrifft dieses Dokument eine pharmazeutische Zusammensetzung, die sich von der Zusammensetzung in dem betreffenden Patent unterscheidet. Darüber hinaus wird das HPMC in D2 nur anhand der Viskosität beschrieben.
D2 zeigt auch, dass "die Freisetzungskinetik der Matrixtablette nicht von der Menge oder Qualität des verwendeten Cellulosederivats beeinflusst wird." Jedoch wird darin die Existenz einer besonderen Synergie zwischen Trimetazidin und dem Cellulosederivat eingeräumt (D2).
Die Kammer stellte fest, dass die Wirkstofffreisetzung durch das Zweikomponentensystem im Vergleich zu D2, in dem ein Einkomponentensystem zur kontrollierten Freisetzung verwendet wird, verzögert erfolgt.
Die Kammer nahm zur Kenntnis, dass in D1 der Wirkstoff Trimetazidin in einer Menge von 60 mg (d. h. zwischen 8 und 50 Gew.-%) vorliegt, das Hydrokolloid aus Cellulosederivat einschließlich HPMC gebildet wird und die hydrophobe Komponente ein hydriertes Öl sein kann, ohne dass Baumwollsaatöl genannt wird. D1 gibt weder die Viskositäts- und Granularitätseigenschaften des HPMC in dem betreffenden Patent noch das Zuordnungsverhältnis zwischen der hydrophilen und der hydrophoben Komponente an.
Darüber hinaus wird in D1 zwar die Möglichkeit genannt, hydriertes Castoröl als hydrophobe Komponente zu verwenden, doch wird kein Ausführungsbeispiel für eine Formulierung mit einem hydrierten Öl beschrieben.
Auch wird in D1 keine In-vivo- oder In-vitro-Studie zur Wirkstofffreisetzungskinetik einer Formulierung mit einem hydrierten Öl beschrieben.
Gestützt auf die in der Marktzulassung, in D1, D2 und Pharmaceutical Technology enthaltenen Kenntnisse befand die Kammer, dass ein Fachmann die technische Lösung des Patents nach den Ansprüchen ohne eine erfinderische Tätigkeit zur Erzielung der wesentlichen technischen Eigenschaften des Zweikomponentensystems für die Freisetzung von Trimetazidin nicht ausführen könnte.
Somit stellte die Kammer fest, dass die beanspruchte Erfindung als Ganzes eine erfinderische Tätigkeit gemäß Artikel 12(1) des Patentgesetzes 64/1991 in der neuen Fassung und Artikel 47 des Regierungsbeschlusses 547/2008 umfasste.
V.5. Zur Tatsache, dass "der Gegenstand des Patents laut Anmeldung die Erfindung nicht so hinreichend deutlich und vollständig offenbart, dass ein Fachmann sie ausführen kann", stellte die Kammer Folgendes fest:
Aufgrund einer Analyse der ursprünglich eingereichten Beschreibung stellte die Kammer fest, dass die fünf Ausführungsformen der Erfindung die qualitative und quantitative Zusammensetzung der filmbeschichteten Tablette sowie die Funktion, die physikalischen und chemischen Eigenschaften einer jeden Komponente zeigen. Die kumulative Wirkung des Zweikomponentensystems (hydrophil-hydrophob) auf die Wirkstofffreisetzungskinetik ist als pharmakokinetisches Merkmal in Fachstudien unabdingbar, für einen Fachmann, der die Erfindung ausführen möchte, jedoch weniger relevant.
Daher befand die Kammer, dass die Komponenten der filmbeschichteten Tablette und das entsprechende Herstellungsverfahren, die in der ursprünglichen Anmeldung und im erteilten Patent beschrieben sind, gemäß Artikel 18 des Patentgesetzes 64/1991 in der neuen Fassung so hinreichend deutlich und vollständig offenbart werden, dass der Fachmann die Erfindung ausführen kann.
Somit stellte die Kammer mehrheitlich fest, dass die Erfindung, deren Gegenstand das Produkt – eine filmbeschichtete Tablette mit veränderter Wirkstofffreisetzung mit 35 mg Trimetazidindihydrochlorid – und das entsprechende Herstellungsverfahren ist, nach Maßgabe von Artikel 7 des Patentgesetzes 64/1991 in der neuen Fassung von 2007 neu war, eine erfinderische Tätigkeit umfasste und gewerblich anwendbar war.
Aufgrund der vorstehenden Analyse hat die für Erfindungen zuständige Beschwerdekammer nach Maßgabe von Artikel 53 des Patentgesetzes 64/1991 in der Fassung von 2007 und Artikel 59(3c) des Regierungsbeschlusses 547/2008
mehrheitlich BESCHLOSSEN:
- dem von LES ..., FR, vertreten durch den zugelassenen Vertreter SC. CABINET M. OPROIU SRL mit Sitz in Bukarest, eingereichten Antrag auf Widerruf des Patents RO 122 951 mit dem Titel Filmbeschichtete Tablette mit veränderter Wirkstofffreisetzung und entsprechendes Herstellungsverfahren des Inhabers SC ..., Bukarest, teilweise stattzugeben;
- Entscheidung Nr. 3/22/30 März 2010 über die Erteilung des Patents RO 122 951 nur in Bezug auf Anspruch 7 (Verfahrensanspruch) zu ändern wie folgt:
7. Verfahren für die Herstellung der filmbeschichteten Tablette mit veränderter Freisetzung von Trimetazidindihydrochlorid nach Anspruch 1-6, dadurch gekennzeichnet, dass es folgende Schritte umfasst:
i. Mischen von 35 Anteilen Trimetazidindihydrochlorid mit 100 Anteilen Mannitol, 51,5 Anteilen Stärke und 9 Anteilen Polyvinylpyrrolidon, Feuchtgranulierung mit gereinigtem Wasser und Trocknen im Fluidisierungsbad;
ii. Homogenisierung des getrockneten und klassifizierten Granulats mit 50 Anteilen Hydroxypropylmethylcellulose mit einer Viskosität von 15 000 cP und einer Korngröße, mit der 99 % des Materials durch das Sieb mit 40 Maschen gelangt, mit 1,4 Anteilen hydriertem Baumwollsaatöl, 4,2 Anteilen kolloidalem Siliciumdioxid, 6,3 Anteilen Talkum, 2,6 Anteilen Magnesiumstearat und der durch Trocknungsverluste entstehenden Differenz von bis zu 260 Anteilen, die mit Maisstärke ausgeglichen wird;
iii. Komprimieren des pulverisierten Granulats in einer Drehkompressionsmaschine, so dass die resultierenden Kerne eine Bruchfestigkeit in Durchmesserrichtung zwischen 75 und 110 N und eine mittlere Masse von 260 mg +/- 5 % aufweisen.
iv. Suspendieren und Homogenisieren der Suspension durch die Zugabe von 8 Anteilen eines Filmbeschichtungsmittels in gereinigtes Wasser, wobei die Filmbeschichtung unter an sich bekannten Bedingungen mit Natriumcarboxymethylcellulose als Filmbeschichtungsmittel erfolgt.
Die Entscheidung vom 3. Dezember 2010 wurde innerhalb von 30 Tagen nach Mitteilung vor dem Gerichtshof in Bukarest angefochten.
VI. Abweichende Meinung
4. Analyse der Gründe und Gegenargumente
4.1. Zum ersten Grund stellte die Kammer fest, dass die Behauptung des Antragstellers, die ursprünglich eingereichte Erfindungsbeschreibung enthalte bestimmte (weiter oben ausdrücklich genannte) Merkmale von Anspruch 7 nicht, korrekt war.
Nach Artikel 37(6) b) des Regierungsbeschlusses 547 von 2008 kann per a contrario der zur Verteidigung vom Inhaber angeführten Begründung, dass "der Gegenstand von Anspruch 16 der Patentanmeldung weiter gefasst als Anspruch 7 des Patents" war, nicht gefolgt werden, da die Verkleinerung des Schutzbereichs des Verfahrens aufgrund von bestimmten Merkmalen erfolgte, die in der ursprünglich eingereichten Beschreibung der Erfindung nicht zu finden waren, entsprechende Änderungen nicht akzeptiert werden konnten und demzufolge "der Gegenstand des Patents über den Inhalt der Patentanmeldung hinausginge".
In Anspruch 7 des Patents sind die Parameter für das Feuchtgranulierungsverfahren angegeben, das im Arzneimittelbereich bekannt ist (siehe WO 1998/036737 – Wet granulating method, veröffentlicht am 27.08.1998) und der Herstellung von Tabletten mit der in den Ansprüchen 1-6 dargelegten Zusammensetzung dient. Zunächst (Anspruch 16 der ursprünglichen Anmeldung) wurden die Verfahrensmerkmale wie folgt angegeben: "ein vorgegebenes Massenverhältnis" zwischen dem Wirkstoff (Trimetazidindihydrochlorid), dem Verdünnungsmittel (Mannitol), dem Bindemittel (Maisstärke) und dem Wasser bei der Dosierung und Mischung und eine "vorgegebene Granulierung" des "Cellulosederivats" (HPMC) bei der Kornhomogenisierung.
Die Parameter und Extrainformationen in Anspruch 7 wurden den Angaben des Antragstellers zufolge von der ursprünglichen Beschreibung nicht gestützt.
Während des Widerrufsverfahrens hat der Inhaber diesen Verstoß gegen die Bestimmungen von Regierungsbeschluss GD 547/2008 nicht behoben.
Somit gab die Kammer nach Maßgabe von Artikel 52(1)c) des Patentgesetzes 64/1991 in der Fassung von 2007 dem Antrag auf Widerruf von Anspruch 7 statt, der das Herstellungsverfahren für die filmbeschichtete Tablette mit veränderter Freisetzung von Trimetazidindihydrochlorid betrifft.
4.2. Zum zweiten Grund ließen die Dokumente in der Akte und die vor der Kammer vertretenen Argumente beider Parteien den Schluss zu, dass der Inhaber die filmbeschichtete Tablette mit veränderter Freisetzung von Trimetazidindihydrochlorid nach Anspruch 1 – 6 seit 2004 unter dem Namen TRIMETAZIDINA LPH 35 mg am rumänischen Markt vertrieben hat.
4.2.1. Die entsprechende Marktzulassung 3976/2003/01-02 erhielt der Inhaber am 26. November 2003. In Anlage 1 (Patienteninformation) und in Anlage 2 (Zusammenfassung der Produktmerkmale) dazu war die Zusammensetzung des Produkts TRIMETAZIDINA LPH 35 mg beschrieben wie folgt:
TRIMETAZIDINE LPH® 35 mg
Filmbeschichtete Tablette mit veränderter Freisetzung, 35 mg
Zusammensetzung
Eine filmbeschichtete Tablette mit veränderter Freisetzung enthält 35 mg Trimetazidindihydrochlorid und Hilfsstoffe: Kern – Mannitol, Maisstärke, Hypromellose, Polyvidon K30, Talkum, kolloidales Siliciumdioxid, hydriertes Baumwollsaatöl, Magnesiumstearat, Filmbeschichtung – Opaglos 2 97W24263 Pink.
...
Dosierung und Einnahme
Die empfohlene Dosis ist eine Tablette mit veränderter Freisetzung von TRIMETAZIDIN LPH 35 mg zweimal täglich jeweils morgens und abends mit genügend Wasser während der Mahlzeiten. Beide zuvor genannten Dokumente wurden bei Erteilung der Marktzulassung auf der Website der NMA der Öffentlichkeit zugänglich gemacht. Darüber hinaus werden die Medikamente in Apotheken ohne Geheimhaltungsvereinbarungen verkauft. Deshalb hält die zur Verteidigung des Inhabers angeführte Behauptung, das Produkt werde unter Wahrung des Geschäftsgeheimnisses verkauft, nicht stand.
Mithilfe der zusätzlichen Erklärungen dahingehend, dass Hypromellose die Kurzform von Hydroxypropylmethylcellulose (HPMC) ist und die Dosis von zwei Tabletten täglich ein Hinweis darauf ist, dass das Freisetzungssystem das Trimetazidindihydrochlorid über 12 Stunden freizusetzen vermag, lässt sich festhalten, dass die oben genannte Beschreibung für den über den Stand der Technik (in diesem Fall D2, in dem das "innovative Produkt" – wie es vom Inhaber selbst während der Sitzung genannt wurde – dargestellt wird, und D1) informierten Fachmann ausreicht um festzustellen, dass das in der Patienteninformation beschriebene Produkt über dieselben wesentlichen Merkmale verfügt wie das in Anspruch 1 des betreffenden Patents beanspruchte Produkt, der lautet:
"Filmbeschichtete Tablette mit veränderter Wirkstofffreisetzung und 35 mg Trimetazidindihydrochlorid, dadurch gekennzeichnet, dass der Wirkstoff in den 12 Stunden nach Tabletteneinnahme freigesetzt wird, und zwar durch Verwendung der nicht zur Matrix gehörenden Komponenten Hydroxypropylmethylcellulose und hydriertes Baumwollsaatöl in einem Massenverhältnis von 1/0,02 – 0,08, worin die Hydroxypropylmethylcellulose in einem gravimetrischen Verhältnis von höchstens 25 %, vorzugsweise 18,7 % der Tablettenmasse vorhanden ist, eine Viskosität im Bereich von 4 000 – 100 000 cP und eine Korngröße aufweist, bei der 95 % des Materials durch Siebe mit 20 – 50 Maschen, vorzugsweise 99 % des Materials durch ein Sieb mit 40 Maschen gelangt, wobei das hydrierte Baumwollsaatöl in einem Verhältnis von 0,52 – 2 % der gesamten Tablettenmasse und der Wirkstoff höchstens 15 %, vorzugsweise 13,06 % der Tablettenmasse darstellt."
4.2.2. Die anderen Produktmerkmale nach Anspruch 1 in Bezug auf das Komponentenverhältnis, insbesondere das Massenverhältnis zwischen den beiden Komponenten des Mechanismus für die kontrollierte Wirkstofffreisetzung – HPMC (hydrophil) und hydriertes Baumwollsaatöl (hydrophob) – können mit einer chemischen Analyse der über Apotheken vertriebenen Tabletten bestimmt werden. Das Verhältnis zwischen hydrophiler und hydrophober Komponente in einem Mechanismus für die Freisetzung von Trimetazidindihydrochlorid aus einer pharmazeutischen Zusammensetzung wird auch in D1 analysiert. Insbesondere kann der Anteil des Wirkstoffs an der Tablettenmasse durch das Wiegen einer Tablette im Labor bestimmt werden, wenn die Menge des Wirkstoffs (35 mg) bekannt ist.
Die Viskositäts- und Granularitätseigenschaften von HPMC beeinflussen den Tabletteninhalt nicht wesentlich, sondern sind für das Produkt von zweitrangiger Bedeutung (es handelt sich vielmehr um verfahrensspezifische Merkmale) und gehören der Argumentation des Antragstellers zufolge zum Stand der Technik.
4.2.3. Während des Widerrufverfahrens konnte der Inhaber kein einziges wesentliches Merkmal nach Anspruch 1 nennen, das nicht durch Benutzung hätte offenbart werden können, und er änderte den Anspruch nicht entsprechend. Die Ansprüche 2 – 6 hängen von Anspruch 1 ab und können daher ohne diesen nicht in einem Patent aufrechterhalten werden.
Somit stimmte die Kammer aufgrund von Artikel 52(1)a) des Gesetzes 64/1991 in der Fassung von 2007 dafür, dass dem Widerrufsantrag in Bezug auf die Ansprüche 1 – 6 betreffend die filmbeschichtete Tablette mit veränderter Freisetzung von Trimetazidindihydrochlorid stattgegeben wird, da das Produkt vor Einreichung der Patentanmeldung durch freiwillige Benutzung offenbart wurde.
5. Aufgrund dieser Schlussfolgerungen befand die Kammer, dass eine Analyse der sonstigen Gründe des Antragstellers sinnlos gewesen wäre, und stimmte für den Widerruf des Patents RO 122 951 mit dem Titel Filmbeschichtete Tablette mit veränderter Wirkstofffreisetzung und entsprechendes Herstellungsverfahren des Inhabers SC ..., Bukarest.
VII. Gegen den Widerruf des Patents RO 122 951B1 im Verwaltungsverfahren ist eine Anfechtungsklage vor dem Gerichtshof von Bukarest anhängig.
Bezüglich der vom Patentinhaber beim Gerichtshof von Bukarest gegen SC ...Bukarest eingereichten Klage wegen Verletzung des in RO über das Erstreckungssystem validierten Patents RO/EP 1 108 424 (D2) beantragte der Kläger (Antragsteller und Inhaber Les ... Frankreich) in seiner Klageschrift, dass:
1. das Gericht die Verletzung der ihm aus dem RO/EP-Patent zustehenden Rechte feststellt.
2. das Gericht den dem Kläger entstandenen Schaden von 6 202 825 EUR (entgangener Gewinn) feststellt und Schadensersatz für die Verletzung der Patentrechte anordnet.
3. das Gericht eine Schadensersatzandrohung („comminatory damages recovery") in Höhe von 500 EUR pro Tag Verzug anordnet.
4. die Entscheidung des Gerichts in den Medien, d. h. in fünf vom Kläger ausgewählten Zeitungen, veröffentlicht wird.
5. der Beklagte die Prozesskosten des Klägers trägt.
Im Zivilurteil Nr. 1331 vom 19. November 2009 entschied der Gerichtshof von Bukarest wie folgt:
"Das Gericht lässt die Berufung teilweise zu, d. h. es weist den Beklagten an, die Herstellung, das Angebot, den Verkauf und die Einfuhr des Produkts zu unterlassen, das Produkt unverzüglich vom rumänischen Markt abzuziehen und alle gewerblichen Tätigkeiten zu beenden, die das Arzneimittel TRIMETAZIDINA LPH 35 mg zum Gegenstand haben.
Das Gericht ordnet die Zahlung von Schadensersatz in Höhe von 3 573 584 LEI (etwa 1 Million EUR) durch den Beklagten für die Verletzung von Patentrechten im Zeitraum vom 1. Januar 2006 bis 31. Dezember 2007 an.
Das Gericht ordnet die Zahlung der Prozesskosten des Klägers durch den Beklagten an."
Das Zivilurteil wurde von beiden Parteien vor dem Berufungsgericht von Bukarest angefochten (Aktenzeichen 21477/3/2006 vom 30. September 2010, http:\\portal.just.ro). Die Entscheidung des Berufungsgerichts wurde am 27. Oktober 2011 wie folgt gefällt:
"Das angefochtene Urteil wurde vollständig geändert, d. h. das Gericht nimmt zur Kenntnis, dass der Beschwerdeführer auf eine Anhörung zu der Sache verzichtet hat, und ordnet die Zahlung der Prozesskosten des Beklagten in Höhe von 244.274.43 durch den Kläger an."
Da keine Rechtsmittel eingelegt wurden, ist das Zivilurteil rechtskräftig.
Außerdem reichte LES ..., FR, Klage wegen Verletzung des in RO über das Erstreckungssystem validierten Patents RO/EP 1 108 424 (D2) gegen SC ...GR Rumänien ein.
C. Ein Hersteller von Generika aus DE focht das Patent EP 1 108 424 vor dem EPA an (Einspruch und Beschwerde, Verfahren T 1196/08), und das Patent wurde in geänderter Fassung aufrechterhalten.
Der Interventionsantrag von SC ... GR Romania aufgrund von Artikel 105(1)(a) EPÜ wurde mit der Begründung abgewiesen, dass RO/EP 1 108 424 kein europäisches Patent im Sinne des Münchner Übereinkommens sei.