EXPOSÉS PRÉSENTÉS PAR DES JUGES NATIONAUX
RO Roumanie
Petre OHAN - OSIM - Office d'Etat pour les inventions et les marques - Directeur de la division des recours - Président de la Chambre de recours - Particularités de la révocation administrative dans le droit roumain des brevets (loi n° 64/1991, dans sa version de 2007)
1. Dispositions juridiques de la loi roumaine sur les brevets relatives à la révocation administrative
1.1 La révocation administrative dans le système roumain des brevets
En vertu de la loi sur les brevets (n° 64/1991, telle que modifiée en 2007), le système roumain des brevets ne prévoit pas, selon moi, de procédure d'opposition ou de révocation comparable à celle des autres systèmes de brevets.
Les articles 52, 53 et 56 de la loi sur les brevets disposent toutefois que :
"Toute personne intéressée peut demander à l'OSIM par écrit, en invoquant des motifs valables, que le brevet soit révoqué, et ce dans un délai de six mois à compter de la publication de la mention de la délivrance du brevet" (article 52).
"…[L]a requête en révocation, …, doit être traitée, dans un délai de trois mois à compter de son enregistrement auprès de l'OSIM, par une Chambre de recours au sein de la division des recours de l'OSIM" (article 53).
"Un brevet ne peut pas être révoqué ... sans que son titulaire ait eu la possibilité de présenter des observations sur la révocation ... et d'apporter les modifications et les rectifications autorisées par la loi, dans un délai raisonnable" (article 56).
Ceci étant, mon affirmation est-elle bien fondée ?
En fait, la procédure de "révocation" devant la Chambre de recours en matière de brevets de l'Office roumain de la propriété industrielle (OSIM) combine l'opposition post-délivrance et le recours inter partes.
Procédure "classique" d'opposition post-délivrance au sein des ONB :

Procédure de révocation à l'OSIM :
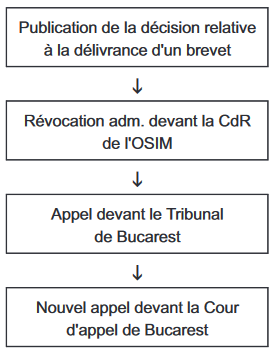
Les raisons en sont les suivantes :
- toute personne intéressée (la partie intéressée) doit respecter un délai (de six mois) pour présenter la requête auprès de l'OSIM
- le titulaire du brevet doit avoir la possibilité de défendre son brevet, d'où le caractère inter partes de la procédure
- la compétence pour statuer sur ces requêtes appartient à la Chambre de recours en matière de brevets de l'OSIM
- la Chambre de recours en matière de brevets se compose comme suit :
- - un président, un rapporteur et un membre juriste de la division des recours ainsi que
- - deux membres techniciens de la direction "brevet"
- s'il est fait droit à la requête, le brevet est révoqué avec effet rétroactif.
1.2 Annulation
Seul le Tribunal municipal de Bucarest peut annuler les brevets délivrés par l'OSIM ainsi que les brevets européens produisant leurs effets en Roumanie.
L'annulation d'un brevet délivré par l'OSIM peut être demandée après l'expiration du délai prévu pour la présentation d'une requête en révocation (article 55).
Cette disposition signifie que, dans le droit roumain, la révocation [administrative] constitue une procédure en "annulation anticipée" qui est du ressort de l'OSIM.
Nous n'avons pas encore d'expérience en ce qui concerne la relation entre la procédure européenne de limitation et les procédures roumaines de limitation et de révocation, mais les juridictions roumaines décideront probablement de surseoir à statuer en cas de procédures parallèles.
L'OSIM n'est pas compétent pour limiter ou révoquer les brevets européens produisant leurs effets en Roumanie.
2. La Commission de réexamen des brevets (Chambre de recours en matière de brevets)
2.1. Nature hybride de la Chambre de recours
La Chambre de recours, appelée "Commission de réexamen des brevets de l'Office d'Etat pour les inventions et les marques (OSIM)", est un organe ayant à la fois des fonctions administratives et juridictionnelles (procédure administrative préliminaire).
Cette situation est liée au fait que, même si la législation roumaine sur les brevets comporte des règles régissant la procédure devant la Commission de réexamen (règles 55 à 59), les dispositions relatives aux attributions juridictionnelles de cette chambre sont complétées "en conséquence" par les dispositions du Code roumain de procédure civile.
Le caractère juridictionnel de cette chambre, plus manifeste dans les affaires inter partes, est mis en évidence par la possibilité qui est donnée aux parties d'être représentées non seulement par un mandataire agréé (avocat en brevets), mais également par un avocat.
2.2 Composition de la Chambre
Dans les affaires de révocation et de limitation, la Chambre est composée :
(a) d'un président, à savoir le Directeur général de l'OSIM ou, par délégation, le Directeur de la division des recours ;
(b) d'un rapporteur, qui est un membre technicien de la division des recours ;
(c) de deux membres techniciens, qui sont désignés parmi les examinateurs d'une division d'examen et ont au moins cinq ans d'expérience chacun, et
(d) d'un membre juriste de la division des recours.
La composition de la Chambre reflète la nature de la procédure (à mi-chemin entre l'opposition et le recours).
3. Aspects d'ordre procédural en cas de limitation et de révocation
La Chambre fait fonction de seconde instance pour les requêtes en limitation, et de première instance dans les procédures de révocation.
Les procédures de recours comprennent deux étapes, l'une écrite et l'autre orale.
3.1 Procédure écrite
La procédure écrite comprend :
- la présentation de la requête écrite et la signification de cette dernière à l'intimé ;
- la formulation par l'intimé d'observations écrites et leur signification au requérant.
Seuls les documents écrits sont acceptés comme moyens de preuve. Les dépositions de témoins ne sont pas admises, mais les déclarations devant notaire le sont.
Conformément au Code roumain de procédure civile, toute partie intéressée peut intervenir dans la procédure de révocation.
3.2 Procédure orale dans tous les cas
Conformément à la loi, la Chambre de recours doit veiller à ce que les parties soient entendues dans chaque affaire avant qu'elle ne rende une décision.
Dans chaque affaire, la commission d'examen (direction "brevet") prend position sur les arguments du requérant/des parties.
3.3 Exceptions de procédure
Conformément à l'article 127 du Code de procédure civile, la Chambre de recours peut, d'office ou à la demande des parties, traiter les exceptions de procédure avant de statuer sur le fond, et ce afin d'accélérer la procédure.
Les cas les plus fréquents sont les suivants :
- requête déposée tardivement ;
- taxe non payée ou montant du paiement erroné ;
- absence d'intérêt pour agir.
3.4 Appel
La décision motivée de la Chambre de recours est communiquée aux parties dans les quinze jours à compter de son prononcé et elle est susceptible d'appel devant le Tribunal de Bucarest dans les trente jours à compter de la date de sa signification.
La décision relative à la révocation paraît au Bulletin officiel de la propriété industrielle.
Pour des raisons techniques, les images insérées dans cet article ne sont disponibles que dans la version PDF.
La décision relative à la procédure de révocation est prise par vote. Dans la majorité des cas, les décisions sont prises à l'unanimité mais quelques-unes l'ont été à la majorité des votes. Dans ces cas-là et conformément au Code de procédure civile, les opinions dissidentes sont enregistrées et largement prises en compte dans la décision écrite. Il s'agit donc d'un processus de décision transparent, dans lequel tous les membres ont le droit d'exprimer leur opinion. Les décisions de la Chambre de recours paraissent au Bulletin officiel de la propriété industrielle.
Si la Chambre de recours décide de conserver le brevet en lui apportant un certain nombre de modifications, l'OSIM publie une nouvelle version (version modifiée) du fascicule de brevet.
4. Statistiques
| 2006 | 2007 | 2008 | 2009 | 2010 | 2011 |
|---|---|---|---|---|---|---|
Recours formés lors des années précédentes et non encore réglés |
3 |
4 |
10 |
11 |
14 |
9 |
Recours formés durant l'année |
23 |
25 |
26 |
33 |
34 |
13 |
Total des recours réglés dont |
22 |
19 |
25 |
31 |
39 |
16 |
|
3 |
4 |
9 |
11 |
14 |
9 |
|
19 |
15 |
16 |
20 |
25 |
7 |
Total des recours réglés dont |
22 |
19 |
25 |
31 |
39 |
16 |
recours auxquels il a été fait droit |
9 |
3 |
9 |
9 |
16 |
4 |
recours rejetés |
13 |
16 |
16 |
21 |
23 |
11 |
autres |
0 |
0 |
0 |
1 |
0 |
1 |
Recours à régler dans les années à venir |
4 |
10 |
11 |
13 |
9 |
6 |
5. Présentation de l'étude de cas CRI 21/2010
5.1. Composition de la Chambre
Président :
Petre Ohan, ingénieur
Membres :
1. Elena Bondar, PhD, rapporteur de l'affaire (division des recours)
2. Cătălina Mihailescu, ingénieur (division des brevets)
3. Irina Babaligea, biochimiste (division des brevets)
4. Carmen Solzaru, conseiller juridique (division des recours)
5.2. Décision de la Chambre de recours n° 212 / 3 décembre 2010 et exposé de l'opinion dissidente (des extraits du texte sont présentés en annexe)
Mots-clés : révocation administrative du brevet RO 122 951 du 7 février 2005 : comprimé pelliculé à libération modifiée de principe actif et procédé de préparation dudit comprimé
- Raisons de la requête en révocation :
- la protection conférée par le brevet s'étend au-delà du contenu technique de la demande
- défaut de nouveauté :
- - utilisation de l'invention avant la date de dépôt de la demande de brevet
- - destruction de la nouveauté par une antériorité
- défaut d'activité inventive
5.3 Documents de l'état de la technique les plus pertinents :
- EP A 1 195 160 (D1), invention publiée le 10 avril 2002, a divulgué un système à deux composants pour la libération du principe actif de la forme pharmaceutique, comprenant un composant hydrophile, HPMC compris, et un composant hydrophobe
- RO/EP 1 108 424 T2 (D2), publié le 20 juin 2001, concerne un comprimé matriciel permettant la libération prolongée de 35 mg de dichlorhydrate de trimétazidine
- L'autorisation roumaine de mise sur le marché n° 3976/2003/01-02 du 26 novembre 2003.
5.4 Situation concernant l'affaire T 1196/08 portée devant l'OEB (procédure de recours après la procédure d'opposition au brevet EP 1 108 424), date de la décision : 10 novembre 2010
Le titulaire du brevet EP 1 108 424 a intenté une action en contrefaçon concernant le brevet RO/EP1108424 T2 (D2), validé en Roumanie par le biais du système d'extension, contre SC ... GR Romania.
La requête en intervention présentée par SC ... GR Romania, sur la base de l'article 105(1)a) CBE, a été rejetée au motif que le brevet RO/EP 1 108 424 n'était pas un brevet européen au sens de la Convention de Munich.
6. Conclusion
La révocation prévue par le système roumain des brevets présente quelques différences par rapport aux autres systèmes nationaux de brevets/au système du brevet européen.
La Chambre de recours en matière de brevets de l'OSIM suit attentivement la jurisprudence de l'OEB en matière de limitation ou de révocation afin d'en tirer des enseignements et de maintenir la pratique roumaine en conformité avec la pratique de l'OEB.
La Chambre tient toutefois également compte de la particularité du système roumain des brevets, en essayant de trouver des solutions conformes à ses dispositions et à ses besoins.
ANNEXE
RO ROUMANIE
Office d'Etat pour les inventions et les marques
Chambre de recours statuant en matière d'inventions
Affaire CRI 21/2010
1. Composition de la Chambre
Président :
Petre Ohan, ingénieur
Membres :
1. Elena Bondar, PhD, rapporteur de l'affaire (division des recours)
2. Cătălina Mihailescu, ingénieur (division des brevets)
3. Irina Babaligea, biochimiste (division des brevets)
4. Carmen Solzaru, conseillère juridique (division des recours)
2. Décision de la Chambre de recours n° 212 / 3 décembre 2010 et exposé de l'opinion dissidente (extraits)
Mots-clés : révocation administrative d'un brevet en Roumanie
Raisons de la requête en révocation :
- la protection conférée par le brevet s'étend au-delà du contenu technique de la demande
- défaut de nouveauté :
- - utilisation de l'invention avant la date de dépôt de la demande de brevet
- - destruction de la nouveauté par une antériorité
- défaut d'activité inventive
ANNEXE
Roumanie
Office d'Etat pour les inventions et les marques
Chambre de recours statuant en matière d'inventions
Affaire CRI 21/2010
Révocation administrative d'un brevet en Roumanie
I. Titre du brevet RO 122 951 du 7 février 2005 : Comprimé pelliculé à libération modifiée de principe actif et procédé de préparation dudit comprimé
Revendications indépendantes :
Revendication 1 - Comprimé pelliculé à libération modifiée de principe actif, contenant 35 mg de dichlorhydrate de trimétazidine, caractérisé en ce que le principe actif est libéré dans les 12 h suivant la prise du comprimé, en utilisant les composants non-matriciels que sont l'hydroxypropylméthylcellulose et l'huile de coton hydrogénée dans un rapport de masse de 1:0,02-1:0,08, dans lequel l'hydroxypropylméthylcellulose représente un pourcentage gravimétrique de 25 %, au maximum, de la masse du comprimé, de préférence 18,7 %, a une viscosité comprise entre 4 000 et 100 000 cP, de préférence 15 000 cP, et une taille de grains adéquate pour permettre à 95 % de la substance de passer à travers des tamis de 20 à 50 mailles, de préférence à 99 % de celle-ci de traverser un tamis de 40 mailles, la proportion de l'huile de coton hydrogénée étant comprise entre 0,52 et 2 % de la masse totale du comprimé et le principe actif représentant 15 %, au maximum, de la masse du comprimé, de préférence 13,06 %.
Revendication 7 - Procédé de préparation du comprimé pelliculé à libération modifiée de dichlorhydrate de trimétazidine, selon les revendications 1-6, caractérisé en ce qu'il comprend les étapes suivantes : ... Cette revendication mentionne essentiellement les étapes de la granulation humide (mélange des composants, granulation humide, séchage, homogénéisation des granulés séchés, compression des granulés pulvérisés, suspension et homogénéisation de la suspension en résultant) ainsi que les paramètres applicables.
II. Motifs avancés par le requérant
1. Eu égard aux revendications indépendantes (revendications 1 et 7) du brevet RO 122 951, dont le titulaire est SC ... Bucarest, Les ... France, représenté par le mandataire agréé ..., le requérant a appuyé sa requête en révocation en invoquant les motifs suivants, notamment :
- la demande de brevet a fait l'objet d'importantes modifications, celles-ci étant irrecevables en vertu de l'article 27(5) de la loi sur les brevets 64/1991, dans sa version de 2007 (dénommée ci-après la Loi), étant donné qu'elles s'étendaient au-delà du dépôt initial ; cet argument a été invoqué conformément aux dispositions de l'article 52(1)c) de la Loi et
- l'exigence de nouveauté n'est pas satisfaite parce que
- l'objet de la demande de brevet a 200 500 886 a été utilisé publiquement par le déposant avant la date de dépôt de la demande de brevet, à savoir le 7 février 2005 ;
- l'objet de l'invention était connu sur la base du fascicule de brevet RO/EP 1 108 424 (D2), correspondant à la demande de brevet européen n° 00 403 533.3 du 15 décembre 2000, avec le numéro de priorité FR 9 915 960 du 17 décembre 1999, dans lequel RO était désigné par le biais du système d'extension (loi 32/1997), le document destructeur de nouveauté – demande de brevet européen n° 00 308 774.9 du 5 octobre 2000, publiée le 10 avril 2002 (sur la base de laquelle le brevet EP 1 195 160 B1 a été délivré et publié le 16 septembre 2009) – étant pris en compte en tant que tel ou "en tant que document inclus ... dans D1".
- l'exigence d'activité inventive n'est pas satisfaite
en vertu de l'article 12 de la Loi et de l'article 46 de son règlement d'exécution et eu égard à l'état de la technique suivant : RO/EP 1 108 424 (D2), le brevet EP-A 1 195 160 (D1) et la demande de brevet pertinente ; l'autorisation de mise sur le marché du produit Trimetazidina LPH 35 mg et les connaissances générales de la technique pharmaceutique.
1.1. Pour appuyer le premier motif invoqué, le requérant a montré que la revendication 7 comprenait des caractéristiques techniques qui ne figuraient pas dans la description de l'invention, telle qu'exposée dans le dépôt initial, notamment :
- [la granulation humide] avec 13 mesures par masse d'eau purifiée, pendant maximum 15 min ; la granulation ainsi obtenue est suivie par le séchage des granulés dans un lit fluidisé à une température maximale de 40 °C, pendant deux heures maximum (phase I) ;
- la durée d'homogénéisation de 35 min ainsi que la compensation des pertes au séchage par de l'amidon de maïs (phase ii) ;
- les paramètres de résistance à la rupture du noyau comprise entre 75 et 110 N et une masse moyenne du noyau de 260 mg, +/- 5 % (phase iii) ;
- tous les paramètres et leurs valeurs ont été ajoutés par la suite, à la phase iv.
1.2. Pour appuyer le deuxième motif invoqué, le requérant a montré que l'objet du brevet RO 122 951, c.-à-d. le comprimé, ne constituait pas une nouveauté, puisqu'il avait été divulgué par son usage public et sa mise sur le marché en tant que produit.
SC Labormed Pharma S.A. a obtenu en 2003 l'autorisation de mise sur le marché du produit qui fait l'objet des revendications 1-6 et vend celui-ci depuis 2004. A cet effet, SC Labormed Pharma S.A. a pris, dans le cadre des lois en vigueur, toutes les mesures nécessaires pour obtenir le prix du produit et pour faire inscrire ce dernier sur la liste des produits pharmaceutiques subventionnés ; elle a mené des campagnes publicitaires pour le produit qu'elle a introduit dans des réseaux de distribution en s'appuyant sur l'autorisation de mise sur le marché n° 3976/2003/01-02 du 26 novembre 2003. Cette autorisation stipule toutes les principales caractéristiques du produit Trimétazidine LPH 35 mg, telles que définies dans les revendications 1-6 du brevet :
"le produit en tant que tel, vendu sur le marché des produits pharmaceutiques, contient tous les éléments énoncés dans les revendications 1-6 et rendus accessibles au public par un usage ; par conséquent, les revendications 1-6 ne satisfont pas à l'exigence de nouveauté le jour du dépôt de la demande".
1.3. Pour appuyer le deuxième motif invoqué, le problème technique résolu par l'invention revendiquée dans le brevet RO 122 951, par rapport aux documents de l'état de la technique cités, est évident au sens de l'article 12(1) de la Loi, cf. l'article 47(10)h) du règlement d'exécution de ladite Loi.
Le problème technique, résolu par le brevet RO 122 951, consiste à préparer un comprimé ayant comme principe actif 35 mg de dichlorhydrate de trimétazidine dont la libération contrôlée a lieu dans les 12 heures suivant la prise.
Le problème technique est résolu par le mélange de deux agents destinés à contrôler la libération du principe actif : l'hydroxypropylméthylcellulose (HPMC) et l'huile de coton hydrogénée dans une proportion de 50 : 1.
Le document D2, publié le 20 juin 2001, concerne un comprimé matriciel pour la libération prolongée de 35 mg de dichlorhydrate de trimétazidine, celle-ci étant contrôlée par l'utilisation d'un polymère dérivé de cellulose, choisi parmi l'hydroxypropylcellulose, l'hydroxyéthylcellulose, l'hydroxyméthylcellulose, la méthylcellulose et l'hydroxypropylméthylcellulose.
La formulation préférée contient de l'hydroxypropylméthylcellulose (HPMC) mais aussi un liant, un diluant, un lubrifiant et un agent d'écoulement. Le comprimé est prévu pour être administré deux fois par jour - la libération prolongée intervenant chaque fois dans les 12 heures suivant la prise - et pour être utilisé dans le traitement prophylactique de l'angine de poitrine, lors des atteintes choriorétiniennes ainsi que dans le traitement des vertiges d'origine vasculaire.
Le document D1, publié au bulletin de l'OEB 2002/15 le 10 avril 2002, concerne une composition pharmaceutique à libération contrôlée basée sur du dichlorhydrate de trimétazidine combiné à des substances formant des hydrocolloïdes ainsi qu'à des huiles hydrogénées.
L'autorisation de mise sur le marché n° 3976/2003/01-02 présente une composition qualitative et quantitative d'un comprimé pelliculé à libération modifiée comprenant 35 mg de dichlorhydrate de trimétazidine, de l'HPMC et de l'huile de coton hydrogénée dans une proportion de 50 : 1,4.
Conformément à la loi et selon la pratique dans le domaine de l'examen des demandes de brevet, y compris la pratique de l'OEB, l'activité inventive devrait être examinée en appliquant l'approche problème-solution.
- Les principaux éléments permettant la libération contrôlée du principe actif et la résolution du problème technique dans le brevet RO 122 951 sont l'HPMC ayant une viscosité de 100 000 cP, de préférence 4 000 cP, et une huile de coton hydrogénée, dans une proportion de 50 : 1.4, tous les deux étant bien connus de l'état de la technique. Les autres substances servant de molécules porteuses dans le comprimé à base de dichlorhydrate de trimétazidine sont des substances connues dans le domaine et à la disposition de tout homme du métier.
- Les substances ajoutées dans le produit faisant l'objet du brevet RO 122 951 pour contrôler la libération du principe actif sur une période de 12 heures ne diffèrent pas de celles connues et utilisées dans le même but, telles qu'elles sont exposées dans les documents D2 et D1 et dans l'autorisation de mise sur le marché n° 3976/2003/01-02.
La libération du principe actif présentée dans le document D2 est presque identique à celle exposée dans le brevet RO 122 951, ce qui prouve que la façon de résoudre le problème technique énoncée dans le brevet RO 122 951 ne représente aucun progrès dans le domaine technique en question, tel que le prévoit l'article 16(1)d) du règlement d'exécution. Autrement dit, il n'y aucune activité inventive par rapport à la solution technique exposée dans le document D2.
En ce qui concerne l'activité inventive de la revendication 7, le procédé de préparation du comprimé est également connu sur la base des documents de l'état de la technique. Le seul fait de spécifier les valeurs de viscosité et de granulométrie de l'HPMC, dans la fourchette indiquée dans le document D2, ne constitue pas un progrès ou une contribution à l'état de la technique.
En conclusion, le brevet RO 122 951 n'implique pas une activité inventive par comparaison à l'état de la technique étant donné qu'il décrit une utilisation évidente de moyens connus et utilisés dans le même but, sans engendrer des effets nouveaux ou surprenants, manquant par conséquent de satisfaire à l'exigence d'activité inventive telle que la prévoit l'article 47(9)a).
III. Motifs avancés par le titulaire du brevet
2. Le titulaire du brevet, représenté par le mandataire agréé ..., a répliqué aux arguments susmentionnés par les éléments de justification suivants :
2.1. L'étendue de la revendication 16 de la demande de brevet initiale est plus large que celle de la revendication 7 du brevet susmentionné, si bien que celle-ci ne s'étend pas au-delà du contenu de la demande de brevet initiale ; au contraire, son contenu est plus restreint.
a) Plus précisément, la version initiale de la demande de brevet fait référence - à la page 3, paragraphe 2, à la page 4, paragraphes 4, 5 et 6 et dans la revendication 16 - aux caractéristiques du procédé technique utilisé, à savoir la granulation humide. Les proportions de mélange des composants sont implicites ; elles découlent de la formule préférée F1 stipulée dans la demande. L'ordre d'ajout/de mélange desdits composants est également spécifié. Dans le brevet délivré, d'autres éléments dudit procédé étaient aussi précisés, notamment la quantité d'eau (ne devant pas en tous cas se trouver dans le produit final), la durée de granulation, la température et la durée du séchage par lit fluidisé, la durée d'homogénéisation, la dureté des comprimés, la suspension et l'homogénéisation de la pellicule protectrice et certains paramètres du procédé de pelliculage.
b) Tous ces détails ont été présentés en réponse aux demandes de l'OSIM et ne peuvent donc pas être jugés comme dépassant le cadre de la demande initiale, dans la mesure où ils spécifient des modes de travail ou des paramètres d'exploitation qui sont évidents d'un point vue technique (la demande initiale mentionne l'exécution du procédé de granulation humide et traite à la fois les profils in vivo et in vitro). Toute personne de compétence moyenne dans le domaine des techniques pharmaceutiques sait que la granulation humide ne doit pas durer plus d'une heure, que la température de séchage par lit fluidisé ne doit pas dépasser 75 à 100 °C, que la presse de la machine rotative doit être réglée sur une valeur donnée, destinée à conférer aux comprimés une résistance à la rupture inférieure à 150 N, que la pellicule protectrice doit être en suspension et homogénéisée, que la température du pelliculage ne doit pas dépasser la température de vaporisation de la substance en suspension, etc.". "La restriction du contenu..." s'est faite par rapport à des limites implicites supérieures, connues de toute personne compétente dans le domaine de la formulation pharmaceutique. Concernant l'exemple 6, à savoir la cinétique de libération in vivo, il spécifie uniquement une caractéristique du produit obtenue conformément au brevet (à savoir la formule préférée F1).
c) Comme le montre la doctrine, la limitation des possibilités de modifier une demande de brevet à certains cas prévus explicitement par la Loi est nécessaire pour conférer une sécurité juridique au brevet, en particulier vis-à-vis de tiers. A cet effet, les dispositions de l'article 27(5) de la Loi devraient être comprises en ce sens que les modifications ne doivent pas dépasser le contenu de la demande le jour de son dépôt, autrement dit ne pas s'étendre au-delà de l'objet de la demande. A contrario, dans le cas où les modifications apportées en conséquence restreignent la protection demandée, elles doivent être admises. Dans l'affaire concernée, les dispositions de l'article 27(5) de la loi sur les brevets 64/1991 ont par conséquent été entièrement respectées.
Les données dans l'exemple 6 et la figure 2 sont des paramètres pharmacocinétiques résultant d'expériences in vivo qui sont compris implicitement dans le dépôt initial, étant donné que les résultats desdites expériences datent de 2004, avant le dépôt de la demande de brevet auprès de l'OSIM, et que des références y sont faites dans l'étude de bioéquivalence présentée à l'agence nationale des médicaments (National Medicines Agency, NMA).
2.2. Justification de la nouveauté
2.2.1. Comparaison entre la revendication 1 du brevet RO 122 951 et la revendication 1 du brevet RO/EP 1 108 424 (D2)
RO 122951 | EP 1108424 (D2) |
|---|---|
Comprimé pelliculé à libération modifiée de principe actif, contenant 35 mg de dichlorhydrate de trimétazidine |
Comprimé matriciel permettant la libération prolongée de trimétazidine ou d'un de ses sels pharmaceutiquement acceptables |
Le principe actif est libéré en utilisant deux composants non-matriciels : l'hydroxypropylméthylcellulose (HPMC) et l'huile de coton hydrogénée |
La libération prolongée est contrôlée par l'utilisation d'un seul composant : un polymère dérivé de cellulose, présent dans la matrice et choisi parmi l'hydroxypropylcellulose, l'hydroxyéthylcellulose, l'hydroxyméthylcellulose, la méthylcellulose et l'hydroxypropylméthylcellulose. |
Le contenu, la granulosité et la viscosité de l'HPMC ont une influence sur la cinétique de la libération du principe actif. |
Le contenu, la granulosité et la viscosité de l'HPMC n'ont aucune influence sur la cinétique de la libération du principe actif. |
Le rapport HPMC/huile de coton hydrogénée dans le produit faisant l'objet de la revendication est de 1:0,02...1:0,08, et a une influence sur la libération retardée de trimétazidine du fait de la synergie spécifique résultant de la combinaison de l'HPMC et de l'huile hydrogénée. |
Le produit faisant l'objet de la revendication ne contient pas d'huile de coton hydrogénée. La libération prolongée de trimétazidine est le fait de l'action d'un seul composant, choisi parmi l'hydroxypropylcellulose, l'hydroxyéthylcellulose, l'hydroxyméthylcellulose, la méthylcellulose et l'hydroxypropylméthylcellulose. |
- Le brevet RO 122 951 revendique la protection d'une nouvelle composition capable d'entraîner la libération retardée du principe actif.
- Comparée à la revendication 16 (revendication portant sur le procédé) énoncée dans le document D2, la revendication 7 (revendication portant sur le procédé) du brevet RO 122 951 présente d'importantes différences : la libération retardée du principe actif est contrôlée sur la base de deux composants, à la différence du procédé décrit dans le document D2, dans lequel la libération retardée est contrôlée sur la base d'une seule catégorie de composants.
- Dans le brevet RO 122 951, le profil de libération prolongée du principe actif dépend du rapport de masse entre l'HPMC et l'huile hydrogénée et de la granulométrie et la viscosité de l'HPMC.
- Dans le document D2, le contrôle de la libération du dichlorhydrate de trimétazidine dépend d'un seul agent de contrôle.
La quantité de principe actif dans la formulation ainsi que la quantité de l'agent contrôlant la libération sont complémentaires, dans les deux documents mis en opposition : dans le brevet RO 122 951, le dichlorhydrate de trimétazidine est présent dans une proportion de 15 %, au maximum, de la masse du comprimé, tandis que, dans le document D2, il représente 15 à 30 % de la masse du comprimé ; dans le brevet RO 122 951, HPMC est présent dans une proportion de 25 %, au maximum, de la masse du comprimé, de préférence 18,7 %, tandis que, dans le document D2, son rapport à la masse du comprimé est compris entre 25 et 50 %.
- Bien que les deux procédés utilisent la granulation humide, celle-ci s'applique à des produits différents : dans le brevet RO 122 951, elle est utilisée pour obtenir un produit qui diffère de celui obtenu dans le document D2.
2.2.2. Bien que le titulaire du brevet ait commercialisé le produit Trimétazidine 35 mg LPH avant la date de dépôt de la demande de brevet n° a 200 500 086, ledit usage n'est pas destructeur de nouveauté puisqu'il s'est fait dans des conditions respectant le secret commercial.
À cet égard, il est fait référence aux articles suivants :
- Article 726(4) de la loi 95/2006 concernant la réforme dans le domaine de la santé publique : l'agence nationale des médicaments met à la disposition du public les résultats du rapport ainsi que les raisons de sa décision, excepté dans le cas d'informations commerciales confidentielles.
- Article 5 de la loi 11/1991 sur la répression de la concurrence déloyale : la divulgation d'informations concernant les résultats d'expériences est interdite.
- Article 39 de l'accord sur les aspects de droits de propriété intellectuelle touchant au commerce (ADPIC) : si l'approbation de la commercialisation de produits pharmaceutiques est subordonnée à la communication aux gouvernements ou aux agences gouvernementales d'informations secrètes à caractère commercial, ces informations devront être protégées en vue d'assurer une protection efficace contre la concurrence déloyale.
2.3. Justification de l'activité inventive
- L'invention revendiquée dans le brevet RO 122 951 implique une activité inventive parce qu'elle se rapporte à une utilisation des moyens techniques de l'invention revendiquée dans le but de résoudre un problème technique d'une autre manière que celle résultant des documents de l'état de la technique analysés par l'homme du métier (article 47(9)f) du règlement d'exécution).
- La solution technique décrite dans le brevet RO 122 951 est une façon à part d'associer certains excipients, dans des conditions données, afin de déterminer la modulation de la libération du dichlorhydrate de trimétazidine dans la forme pharmaceutique, avec pour effet d'obtenir un nouveau produit ayant des propriétés d'usage connues, le produit étant caractérisé par sa robustesse et sa souplesse.
- Ainsi, la libération retardée du principe actif est contrôlée sur la base de deux composants, à savoir l'HPMC et l'huile de coton hydrogénée (dans un certain rapport de masse et avec une granulométrie et une viscosité données), ladite combinaison n'étant pas évidente pour un homme du métier.
IV. Dispositions juridiques pertinentes
3.1. En ce qui concerne les motifs de nullité d'un brevet et la divulgation de l'invention dans le cadre d'un dépôt régulier, la Loi stipule que :
"(1) Toute personne est en droit de demander à l'OSIM par écrit, en invoquant des motifs valables, que le brevet soit révoqué, et ce dans un délai de six mois à compter de la publication de la mention de la délivrance du brevet, à condition que :
a) l'objet du brevet ne soit pas brevetable, en vertu des articles 7-10, 12 et 13 ;
b) l'objet du brevet n'expose pas l'invention de manière suffisamment claire et complète pour qu'un homme du métier puisse l'exécuter ;
c) l'objet du brevet ne s'étende pas au-delà du contenu de la demande de brevet, telle qu'elle a été déposée.
(2) Si les motifs de nullité n'affectent qu'une partie du brevet, la nullité est prononcée sous la forme d'une limitation correspondante dudit brevet" (article 52 de la loi sur les brevets 64/1991, dans sa version de 2007).
3.2. En ce qui concerne la recevabilité des modifications de la demande de brevet après le dépôt régulier, la Loi stipule que :
"A la demande de l'OSIM ou à sa propre initiative, le déposant [...] peut, jusqu'à ce qu'une décision soit prise, modifier la demande de brevet, à condition que l'exposé de l'invention ne s'étende pas au-delà du contenu de la demande de brevet à la date du dépôt" (article 27(5) de la loi sur les brevets 64/1991, dans sa version de 2007).
Lesdites dispositions sont expliquées à l'article 37(6)b) de la décision gouvernementale n° 547/2008 :
"Les modifications apportées par le déposant ou le mandataire agréé, selon le cas, durant l'examen préliminaire ou l'examen quant au fond, doivent être acceptées par l'OSIM si elles :
[...]b) font référence au contenu des revendications mais se basent sur les caractéristiques existant dans la description et les dessins dans le dépôt national régulier ;"
3.3. En ce qui concerne la divulgation de l'invention par un usage, avant la date de dépôt de la demande de brevet, la Loi stipule ce qui suit :
"(1) Une invention est considérée comme nouvelle si elle n'est pas comprise dans l'état de la technique.
(2) L'état de la technique est constitué par tout ce qui a été rendu accessible au public avant la date de dépôt de la demande de brevet par une description écrite ou orale, un usage ou tout autre moyen." (article 10 de la loi sur les brevets 64/1991, dans sa version de 2007).
Lesdites dispositions sont expliquées à l'article 38(8) de la décision gouvernementale n° 547/2008 :
"Les informations sont considérées comme ayant été rendues accessibles au public par un usage, au sens de l'article 10, paragraphe (2) de la Loi, si, à la date pertinente, toute personne pouvait obtenir lesdites informations par voie d'affichage ou d'usage. Si une personne vend un article à un tiers sans limitations, restrictions ou obligations en termes de confidentialité, l'article est considéré comme ayant été rendu accessible au public".
V. DÉCISION DE LA CHAMBRE DE RECOURS N° 212 / 3 décembre 2010
V.1. Extension au-delà du dépôt initial par l'ajout de nouveaux paramètres dans la revendication 7 (revendication portant sur le procédé).
- La Chambre a décidé de modifier la revendication 7 en supprimant de son texte tous les paramètres qui ne se fondent pas sur la description initiale (durée de suspension, quantité d'eau purifiée, viscosité de la suspension en résultant, vitesse de rotation du tambour, vitesse de chargement de la suspension, pression et température dans le lit fluidisé, pourcentage de carboxyméthylcellulose de sodium).
Revendication 7, telle que modifiée par la Chambre :
"7. Procédé de préparation du comprimé pelliculé à libération modifiée de dichlorhydrate de trimétazidine, selon les revendications 1-6, caractérisé en ce qu'il comprend les étapes suivantes :
i. Mélange de 35 mesures de dichlorhydrate de trimétazidine avec 100 mesures de mannitol, 51,5 mesures d'amidon et 9 mesures de polyvinylpyrrolidone, granulation humide avec de l'eau purifiée et séchage par lit fluidisé ;
ii. Homogénéisation des granulés séchés et classifiés, pendant 35 min, avec 50 mesures d'hydroxypropylméthylcellulose, ayant une viscosité de 15 000 cP et une taille de grains adéquate pour permettre à 99 % de la substance de passer à travers un tamis de 40 mailles, avec 1,4 mesure d'huile de coton hydrogénée, 4,2 mesures de dioxyde de silicium colloïdal, 6,3 mesures de talc, 2,6 mesures de stéarate de magnésium et la différence de maximum 260 mesures résultant des pertes au séchage compensée par de l'amidon de maïs ;
iii. Compression des granulés pulvérisés dans une machine à comprimer rotative de sorte que les noyaux en résultant présentent une résistance à la rupture diamétrale comprise entre 75 et 110 N et une masse moyenne de 260 mg, +/- 5 %.
iv. Suspension et homogénéisation de la suspension en incorporant 8 mesures d'un agent de pelliculage dans l'eau purifiée, le pelliculage étant réalisé dans des conditions connues en soi, utilisant la carboxyméthylcellulose de sodium comme agent de pelliculage".
V.2. L'exemple 6 présente le profil de libération in vivo du principe actif mettant en évidence les paramètres pharmacocinétiques de la formulation préférée de l'invention.
La figure 2, qui n'était pourtant pas comprise dans le dépôt initial, est une représentation graphique de la concentration plasmatique moyenne de la formulation préférée de l'invention.
Toutes ces données peuvent être conservées dans la description de l'invention étant donné qu'elles sont destinées à permettre de mieux comprendre l'invention sans influer sur l'étendue de la protection conférée par le brevet.
V.3. Lors de l'appréciation de la nouveauté, la Chambre a considéré que :
Le document de l'état de la technique le plus pertinent pour apprécier, par comparaison, la nouveauté du brevet concerné est le document EP A 1 195 160 (D1) pour les raisons suivantes :
a. À la date du dépôt national régulier de la demande de brevet a 200 500 086 du 7 février 2005, D1 était déjà un document public (date de publication : 10 avril 2002). Le brevet EP 1 195 160, publié le 16 septembre 2009, n'existait pas à l'époque.
b. D1 présente un système à deux composants pour la libération du principe actif de la forme pharmaceutique, à savoir un composant hydrophile, HPMC compris, et un composant hydrophobe, comprenant des acides gras, des alcools gras et de l'huile hydrogénée, qui assure la libération prolongée de trimétazidine sur une période de 24 h maximum, de préférence 18 h (revendication 15) et d'au moins 12 h (revendication 15) après administration par voie orale.
L'huile hydrogénée est une caractéristique essentielle de l'invention, telle que revendiquée, ainsi que l'HPMC. Dans D1, le système de libération contrôlée du principe actif est un système à deux composants qui peut comprendre des huiles hydrogénées en plus de l'HPMC.
Dans RO/EP 1 108 424 T2 (D2), le principe actif est libéré par un seul composant, à savoir HPMC.
La Chambre a établi que D2 ne comprend pas le composant hydrophobe qui représente l'une des caractéristiques essentielles de l'invention spécifiée dans RO 122 951.
Par conséquent, la Chambre a considéré que la nouveauté a été appréciée correctement en relation avec le document D1, qui regroupe plus de caractéristiques essentielles de l'invention que D2.
V.3.2. En ce qui concerne l'appréciation de la nouveauté en relation avec les documents inclus dans le dossier de demande d'autorisation présenté par le titulaire en vue d'obtenir l'autorisation de mise sur le marché n° 3976/2003/01-02 du 26 novembre 2003, la Chambre a établi que :
V.3.2.1. L'autorisation de mise sur le marché délivrée par l'agence nationale des médicaments (NMA) constitue une autorisation provisoire de commercialiser le produit Trimétazidine 35 mg. Ladite autorisation est antérieure à la date de dépôt de la demande de brevet et présente la composition quantitative et qualitative du produit Trimétazidine, sans mentionner toutes les caractéristiques essentielles du comprimé pelliculé et le procédé de préparation dudit comprimé, tels que revendiqués.
Le lieu et la date de publication du dossier de demande d'autorisation ne sont pas clairement indiqués dans les annexes de l'autorisation de mise sur le marché (notice d'information aux patients - Trimétazidine 35 mg, abrégé des caractéristiques du produit, informations sur l'étiquetage).
Lesdits extraits du bulletin de la NMA mentionnent uniquement la demande d'autorisation de mise sur le marché et la délivrance de ladite autorisation. Ils ne présentent pas in extenso tous les documents compris dans le dossier de demande d'autorisation, tel que le requiert la NMA pour délivrer l'autorisation de mise sur le marché du produit.
L'étude de bioéquivalence, requise pour prouver la capacité du produit Trimétazidine LPH 35 mg (produit générique) à produire le même effet biopharmaceutique que le produit Preductal 35 mg (produit de référence), indique que toute la documentation est déposée auprès de la NMA dans des conditions basées sur un accord de confidentialité conclu entre la NMA et le titulaire du produit.
Par conséquent, la Chambre a considéré que les documents compris dans le dossier de demande d'autorisation n'étaient pas publics, à l'exception des trois premières annexes de l'autorisation de mise sur le marché, conformément à l'article 38(9) de la décision gouvernementale n° 547/2008 : "Les informations qui ont été rendues accessibles au public verbalement, par un usage ou tout autre moyen doivent être considérées comme faisant partie de l'état de la technique uniquement si elles sont confirmées par un document daté faisant référence à leur existence et prouvant la date à laquelle elles ont été rendues accessibles au public".
La Chambre a toutefois analysé ces documents présentés par le requérant.
Ainsi, la Chambre a établi que la notice d'information aux patients (faisant partie de l'autorisation de mise sur le marché) et l'abrégé des caractéristiques du produit ne divulguaient ni des données concernant le système à deux composants pour la libération du principe actif ni des données relatives au procédé de préparation du comprimé pelliculé.
Bien que l'autorisation de mise sur le marché comprenne des données relatives à la composition qualitative et quantitative du produit, elle ne spécifie pas les caractéristiques d'HPMC (viscosité et granulométrie) ou les étapes du procédé de préparation du comprimé pelliculé, telles que revendiquées.
L'autorisation définitive de mise sur le marché du produit Trimétazidine 35 mg LPH a été délivrée le 30 mai 2005 (postérieurement à la date de dépôt de la demande de brevet).
Dans le protocole de l'étude de bioéquivalence concernant une dose unique ou multiple du produit Trimétazidine LPH 35 mg comparé au produit Vastarel 35 mg et au produit Preductal, la Chambre a trouvé des données concernant le dosage du médicament testé, en dose unique ou multiple, la méthode appliquée et les volontaires s'étant prêtés au test.
Le test de dissolution in vitro met en évidence le caractère de médicament générique du comprimé faisant l'objet des revendications, sans exposer les éléments de nouveauté, tels qu'ils sont revendiqués dans RO 122 951.
Sur la base de l'analyse ci-dessus, la Chambre a considéré que les documents joints par le requérant concernant le défaut de nouveauté ne contenaient pas les caractéristiques techniques essentielles du comprimé pelliculé faisant l'objet du brevet RO 122 951.
V.3.2.2 En ce qui concerne le défaut de nouveauté du comprimé pelliculé du fait de son utilisation avant la date de dépôt,
la Chambre a, conformément à l'article 38(8) et à l'article 38(9) de la décision gouvernementale n° 547/2008, considéré que :
- même si le produit a été rendu accessible au public, par la vente, avant la date de dépôt (7 février 2005), la notice d'information aux patients relative au produit ne divulgue pas complètement les caractéristiques physiques et chimiques du système pour la libération contrôlée du principe actif ;
- même si, suite à la mise sur le marché du produit, tout tiers pouvait déterminer la composition du comprimé pelliculé par une analyse quantitative et qualitative, il n'était pas pour autant en mesure de reproduire les caractéristiques physiques des composants du comprimé à l'origine de la libération du principe actif. De plus, en dehors de la notice d'information aux patients, le requérant n'a pas mis à la disposition de la Chambre des tests ou des analyses de laboratoire du comprimé pelliculé portant une date antérieure à la date de dépôt de la demande de brevet a 2005 00886 et capables de prouver les caractéristiques intrinsèques des composants du comprimé.
Par conséquent, la Chambre a considéré que le produit n'avait pas été rendu entièrement accessible au public.
C'est pourquoi la Chambre a conclu, à la majorité, que les dispositions de l'article 10 de la loi sur les brevets 64/1991, dans sa nouvelle version, avaient été satisfaites.
V.4. En ce qui concerne l'activité inventive, la Chambre a établi que :
- D2 se rapporte à une composition pharmaceutique dans laquelle le système de libération contrôlée du principe actif comprend un seul composant, à savoir HPMC (composant matriciel). Par conséquent, ce document concerne une composition pharmaceutique qui diffère de la composition exposée dans le brevet concerné. De plus, dans D2, HPMC est caractérisé uniquement par sa viscosité.
D2 indique également que la "cinétique de la libération du comprimé matriciel n'est pas influencée par la quantité ou la qualité du dérivé de cellulose utilisé". Il constate cependant l'existence d'une synergie spécifique entre la trimétazidine et le dérivé de cellulose (D2).
La Chambre a constaté que la libération du principe actif par le système à deux composants est retardée par comparaison au D2, qui présente un système de libération contrôlée à un seul composant.
La Chambre a noté que, dans D1, le principe actif trimétazidine est contenu dans une quantité de 60 mg (c.-à-d. entre 8 et 50 % de la masse totale du comprimé), l'agent de formation d'hydrocolloïde est un dérivé de cellulose, HPMC compris, et le composant hydrophobe peut être une huile hydrogénée, sans que l'huile de coton ne soit toutefois mentionnée. D1 ne spécifie pas les caractéristiques de viscosité et de granulométrie de l'HPMC intervenant dans le brevet concerné ou le rapport entre les composants hydrophile et hydrophobe.
De plus, bien que D1 mentionne la possibilité d'utiliser l'huile de ricin hydrogénée comme composant hydrophobe, aucun mode de réalisation d'une formulation contenant une huile hydrogénée n'y est décrit.
En outre, D1 ne décrit aucune étude de cinétique de libération du principe actif in vivo ou in vitro d'une formulation contenant une huile hydrogénée.
Corroborant les informations comprises dans l'autorisation de mise sur le marché, dans les documents D1 et D2 ainsi que dans la Pharmaceutical Technology, la Chambre a considéré qu'un homme du métier de compétence moyenne ne pouvait pas exécuter la solution technique du brevet, telle que revendiquée, sans impliquer une activité inventive pour réaliser les caractéristiques techniques essentielles du système à deux composants pour la libération de Trimétazidine.
C'est pourquoi la Chambre a conclu que l'invention revendiquée impliquait, dans son ensemble, une activité inventive conformément à l'article 12(1) de la loi sur les brevets 64/1991, dans sa nouvelle version, et à l'article 47 de la décision gouvernementale n° 547/2008.
V.5. En ce qui concerne le fait que "l'objet du brevet, tel que déposé, n'expose pas l'invention de manière suffisamment claire et complète pour qu'un homme du métier puisse l'exécuter", la Chambre a conclu que :
Suite à une analyse de la description, telle que déposée initialement, la Chambre établit que les cinq modes de réalisation de l'invention présentent : la composition qualitative et quantitative du comprimé pelliculé, le rôle fonctionnel de chaque composant ainsi que les caractéristiques physiques et chimiques. L'action cumulée des deux composants (hydrophile et hydrophobe) sur la cinétique de libération du principe actif est de nature pharmacocinétique, indispensable dans des études spécialisées mais moins pertinente pour un homme du métier de compétence moyenne ayant l'intention d'exécuter l'invention.
Ainsi, la Chambre a considéré que les composants du comprimé pelliculé et le procédé de préparation dudit comprimé, tels qu'ils sont établis à la fois dans le dépôt initial et le brevet délivré, étaient exposés de manière suffisamment claire et complète, en vertu de l'article 18 de la loi sur les brevets 64/1991, dans sa nouvelle version, pour qu'un homme du métier puisse exécuter l'invention.
Par conséquent, la Chambre a conclu, à la majorité, que l'invention ayant pour objet le produit – c.-à-d. le comprimé pelliculé à libération modifiée du principe actif contenant 35 mg de dichlorhydrate de trimétazidine – et le procédé de préparation dudit comprimé était nouvelle, impliquait une activité inventive et était susceptible d'application industrielle, en vertu de l'article 7 de la loi sur les brevets 64/1991, dans sa version de 2007.
Sur la base de l'analyse susmentionnée et en vertu de l'article 53 de la loi sur les brevets 64/1991, dans sa version de 2007, et de l'article 59(3c) de la décision gouvernementale n° 547/2008, la Chambre de recours statuant en matière d'inventions
A DÉCIDÉ à la majorité :
- de faire droit, en partie, à la requête en révocation déposée par LES ..., FR, représentée par la mandataire agréé SC. CABINET M. OPROIU SRL, dont le siège social est à Bucarest, contre le brevet RO 122 951 intitulé Comprimé pelliculé à libération modifiée de principe actif et procédé de préparation dudit comprimé et dont le titulaire est SC ..., Bucarest ;
- de modifier comme suit la décision n° 3/22/30 mars 2010 de délivrance du brevet RO 122 951 uniquement en ce qui concerne la revendication 7 (revendication portant sur le procédé) :
7. Procédé de préparation du comprimé pelliculé à libération modifiée de dichlorhydrate de trimétazidine, selon les revendications 1-6, caractérisé en ce qu'il comprend les étapes suivantes :
i. Mélange de 35 mesures de dichlorhydrate de trimétazidine avec 100 mesures de mannitol, 51,5 mesures d'amidon et 9 mesures de polyvinylpyrrolidone, granulation humide avec de l'eau purifiée et séchage par lit fluidisé ;
ii. Homogénéisation des granulés séchés et classifiés avec 50 mesures d'hydroxypropylméthylcellulose, ayant une viscosité de 15 000 cP et une taille de grains adéquate pour permettre à 99 % de la substance de passer à travers un tamis de 40 mailles, avec 1,4 mesure d'huile de coton hydrogénée, 4,2 mesures de dioxyde de silicium colloïdal, 6,3 mesures de talc, 2,6 mesures de stéarate de magnésium et la différence de maximum 260 mesures résultant des pertes au séchage compensée par de l'amidon de maïs ;
iii. Compression des granulés pulvérisés dans une machine à comprimer rotative de sorte que les noyaux en résultant présentent une résistance à la rupture diamétrale comprise entre 75 et 110 N et une masse moyenne de 260 mg, +/- 5 %.
iv. Suspension et homogénéisation de la suspension en incorporant 8 mesures d'un agent de pelliculage dans l'eau purifiée, le pelliculage étant réalisé dans des conditions connues en soi, utilisant la carboxyméthylcellulose de sodium comme agent de pelliculage.
Il a été fait appel de la décision, rendue le 3 décembre 2010, devant le Tribunal de Bucarest dans les trente jours à compter de la date de sa signification.
VI. Opinion dissidente
4. Analyse des motifs et des motifs contraires
4.1. En ce qui concerne le premier motif, la Chambre a établi que l'affirmation du requérant était correcte, c.-à-d. que certaines caractéristiques (mentionnées explicitement ci-dessus) de la revendication 7 ne figuraient pas dans le dépôt initial de la description de l'invention.
En vertu de l'article 37(6) b) de la décision gouvernementale n°547/2008, per a contrario, la justification donnée par le titulaire selon laquelle "l'étendue de la revendication 16 de la demande de brevet était plus large que la revendication 7 du brevet" n'est pas recevable au motif que la restriction de protection concernant le procédé se basait sur certaines caractéristiques ne figurant pas dans la description de l'invention dans le dépôt initial, que de telles modifications n'étaient pas acceptables et que, dans ces conditions, "l'objet du brevet s'étendrait au-delà du contenu de la demande de brevet".
La revendication 7 du brevet a défini les paramètres du procédé de granulation humide, qui est connu dans le domaine pharmaceutique (cf. le brevet WO 1998/036737 – Procédé de granulation humide, publié le 27.08.1998) pour la préparation de comprimés ayant la composition présentée dans les revendications 1-6. Au départ (revendication 16 du dépôt initial), les caractéristiques du procédé étaient indiquées comme suit : un "rapport de masse prédéfini" entre le principe actif (dichlorhydrate de trimétazidine), le diluant (mannitol), le liant (amidon de maïs) et l'eau durant la phase de dosage et de mélange, ainsi qu'une "granulométrie prédéfinie" du "dérivé de cellulose" (HPMC) pendant la phase d'homogénéisation des grains.
Les paramètres et les informations supplémentaires figurant dans la revendication 7, tels qu'indiqués par le requérant, ne s'appuyaient pas sur la description initiale.
Tout au long de la procédure de révocation, le titulaire du brevet n'a pas remédié à cette infraction aux dispositions de la décision gouvernementale n° 547/2008.
Par conséquent, en vertu des provisions de l'article 52(1)c) de la loi sur les brevets 64/1991, dans sa version de 2007, la Chambre a fait droit à la requête en révocation de la revendication 7 concernant le procédé de préparation du comprimé pelliculé à libération modifiée de dichlorhydrate de trimétazidine.
4.2. En ce qui concerne le deuxième motif, les documents existants, joints au dossier, et les arguments soutenus devant la Chambre par les deux parties ont conduit à la conclusion que le titulaire commercialisait le comprimé pelliculé à libération modifiée de dichlorhydrate de trimétazidine, tel qu'énoncé dans les revendications 1-6, sur le marché roumain, depuis 2004, sous le nom TRIMETAZIDINA LPH 35 mg.
4.2.1. Dans ce contexte, le titulaire s'était vu délivrer l'autorisation de mise sur le marché 3976/2003/01-02 le 26 novembre 2003. L'annexe 1 (Notice d'information aux patients) et l'annexe 2 (Abrégé des caractéristiques du produit) à ladite autorisation ont exposé la composition du produit TRIMETAZIDINA LPH 35 mg comme suit :
TRIMÉTAZIDINE LPH® 35 mg
Comprimés pelliculés à libération modifiée, 35 mg
Composition
Un comprimé pelliculé à libération modifiée contient 35 mg de dichlorhydrate de trimétazidine et des excipients : mannitol, amidon de maïs, hypromellose, polyvidone K30, talc, dioxyde de silicium colloïdal, huile de coton hydrogénée, stéarate de magnésium dans le noyau du comprimé et Opaglos 2 97W24263 rose pour le pelliculage.
...
Posologie et administration
La dose recommandée est un comprimé à libération modifiée de TRIMÉTAZIDINE LPH 35 mg deux fois par jour, matin et soir, à prendre avec une quantité d'eau suffisante, pendant les repas. Les deux documents susmentionnés ont été mis à la disposition du public sur le site Internet de la NMA à compter de la délivrance de l'autorisation de mise sur le marché. De plus, les médicaments sont vendus dans des pharmacies sans clause de confidentialité. C'est la raison pour laquelle la justification avancée par le titulaire prétendant que le produit a été vendu dans des conditions respectant le secret commercial n'est pas recevable.
Avec les explications supplémentaires précisant que l'hypromellose est le terme abrégé pour désigner l'hydroxypropylméthylcellulose (HPMC) et que la dose de deux comprimés par jour indique que le système de libération est capable de libérer le dichlorhydrate de trimétazidine sur une durée de 12 heures, nous pouvons établir que la description ci-dessus est suffisante pour un homme du métier censé avoir les connaissances de l'état de la technique (représenté, dans ce cas, par le document D2 qui présente le "produit innovant" – tel qu'il a été désigné par son titulaire au cours de la réunion – et par le document D1) pour voir que le produit décrit dans la notice d'information sur le brevet a les mêmes caractéristiques essentielles que le produit présenté dans la revendication 1 du brevet concerné, à savoir :
"Comprimé pelliculé à libération modifiée de principe actif, contenant 35 mg de dichlorhydrate de trimétazidine, caractérisé en ce que le principe actif est libéré dans les 12 h suivant la prise du comprimé, en utilisant les composants non-matriciels que sont l'hydroxypropylméthylcellulose et l'huile de coton hydrogénée dans un rapport de masse de 1:0,02-1:0,08, dans lequel l'hydroxypropylméthylcellulose représente un pourcentage gravimétrique de 25 %, au maximum, de la masse du comprimé, de préférence 18,7 %, a une viscosité comprise entre 4 000 et 100 000 cP, de préférence 15 000 cP, et une taille de grains adéquate pour permettre à 95 % de la substance de passer à travers des tamis de 20 à 50 mailles, de préférence à 99 % de celle-ci de traverser un tamis de 40 mailles, la proportion de l'huile de coton hydrogénée étant comprise entre 0,52 et 2 % de la masse totale du comprimé et le principe actif représentant 15 %, au maximum, de la masse du comprimé, de préférence 13,06 %".
4.2.2. Selon la revendication 1, les autres caractéristiques du produit concernant la proportion des composants, en particulier le rapport de masse entre les deux composants du mécanisme de libération contrôlée du principe actif – à savoir l'HPMC (hydrophile) et l'huile de coton hydrogénée (hydrophobe) – peuvent être déterminées par une analyse chimique des comprimés mis sur le marché par le titulaire et en vente dans les pharmacies. Le rapport composant hydrophile/composant hydrophobe au sein d'un mécanisme de libération de dichlorhydrate de trimétazidine d'une composition pharmaceutique est également analysé dans le document D1. Connaissant en particulier le poids d'un comprimé établi en laboratoire et sachant que la quantité du principe actif est de 35 mg, il est possible de déterminer la proportion du principe actif par rapport à la masse du comprimé, telle qu'énoncée dans la revendication 1 – 13,06 %.
La viscosité et la granulométrie d'HPMC n'affectent pas considérablement le contenu du comprimé, ces caractéristiques étant d'une importance secondaire en ce qui concerne le produit (mais étant par contre plus spécifiques au procédé) et faisant partie de l'état de la technique, selon les arguments avancés par le requérant.
4.2.3. Durant la procédure de révocation, le titulaire n'a pas été en mesure d'indiquer dans la revendication 1 une seule caractéristique essentielle n'ayant pas pu être divulguée par l'usage et n'a pas par conséquent modifié la revendication. Les revendications 2-6 dépendent de la revendication 1 et ne peuvent donc pas être maintenues dans un brevet si la revendication 1 ne subsiste pas.
Par conséquent, sur la base des dispositions de l'article 52(1)a) de la Loi 64/1991, dans sa version de 2007, la Chambre a voté pour que la requête en révocation soit reçue quant aux revendications 1-6 concernant le comprimé pelliculé à libération modifiée de dichlorhydrate de trimétazidine étant donné que le produit a été divulgué par un usage volontaire avant le dépôt de la demande de brevet.
5. Suite à ces conclusions, la Chambre a considéré qu'une analyse des autres motifs du requérant serait inutile et a voté pour la révocation du brevet RO 122 951 intitulé Comprimé pelliculé à libération modifiée de principe actif et procédé de préparation dudit comprimé et dont le titulaire était SC ..., Bucarest.
VII. La procédure de révocation administrative concernant le brevet RO 122 951B1 est en instance dans le cadre de la procédure de recours devant le Tribunal de Bucarest.
Concernant l'action en contrefaçon engagée par le titulaire devant le Tribunal de Bucarest, contre SC...Bucarest, relativement au brevet RO/EP 1 108 424 (D2) validé en Roumanie par le biais du système d'extension, le demandeur (requérant-titulaire Les...France) a, dans sa requête, demandé que :
1. le Tribunal constate l'atteinte aux droits lui ayant été conférés par le brevet RO/EP.
2. le Tribunal établisse le préjudice (manque à gagner) causé au demandeur pour un montant de 6 202 825 EUR et ordonne le versement de dommages-intérêts pour atteinte aux droits du titulaire du brevet.
3. le Tribunal ordonne le versement de dommages-intérêts comminatoires de 500 EUR par jour de retard.
4. le jugement du Tribunal soit publié dans les médias, c.-à-d. dans cinq journaux sélectionnés par le demandeur.
5. l'intimé paie les frais de justice du demandeur.
Par la sentence civile n° 1331 qu'il a prononcée le 19 novembre 2009, le Tribunal de Bucarest a rendu le jugement suivant :
"Le Tribunal fait droit en partie au recours, c.-à-d. qu'il condamne l'intimé à cesser de fabriquer, de proposer à la vente, de vendre ou d'importer le produit, à retirer celui-ci immédiatement du marché roumain et à arrêter tout type d'activité commerciale ayant pour objet le produit pharmaceutique TRIMETAZIDINA LPH 35 mg.
Le Tribunal condamne l'intimé à payer des dommages-intérêts de 3 573 584 LEI (soit 1 million d'euros environ) pour cause d'atteinte aux droits du titulaire du brevet, pour la période allant du 1er janvier 2006 au 31 décembre 2007.
Le Tribunal condamne l'intimé à payer les frais de justice du demandeur".
Les deux parties ont fait appel dudit jugement civil devant la Cour d'appel de Bucarest (dossier 21477/3/2006 du 30 septembre 2010, http:\\portal.just.ro). Celle-ci a rendu sa décision le 27 octobre 2011 en ces termes :
"Le jugement dont il a été fait appel a été entièrement modifié ; autrement dit, la Cour prend acte du fait que le demandeur a renoncé à ce que l'affaire soit entendue et le condamne à payer à l'intimé les frais de justice de 244 274.43 LEI encourus par ce dernier."
Le jugement civil est exécutoire, vu qu'aucun recours n'a été exercé.
De plus, LES ..., FR, a engagé une procédure en contrefaçon concernant le brevet RO/EP 1 108 424 (D2), validé en Roumanie par le biais du système d'extension, contre SC ... GR Romania.
C. Une société allemande de fabrication de produits pharmaceutiques génériques a attaqué le brevet EP 1 108 424 devant l'OEB (procédure d'opposition puis de recours, affaire T 1196/08) et le brevet a été maintenu après avoir été modifié.
La requête en intervention présentée par SC ... GR Romania sur la base de l'article 105(1)a) CBE n'a pas été acceptée au motif que RO/EP 1 108 424 n'était pas un brevet européen au sens de la Convention de Munich.